
科目:gzhx 來源:2011-2012學年江西省會昌中學高二上學期第一次月考化學試卷(帶解析) 題型:計算題
將2molN2和8mol H2在適宜條件下按下式進行反應:N2+3H2 2NH3,當在某一溫度下達到化學平衡狀態,若測得平衡混合氣體對氫氣的相對密度為4.19時,求N2的轉化率?
2NH3,當在某一溫度下達到化學平衡狀態,若測得平衡混合氣體對氫氣的相對密度為4.19時,求N2的轉化率?
科目:gzhx 來源:0110 專項題 題型:計算題
 2NH3,當在某一溫度下達到化學平衡狀態,若測得平衡混合氣體對氫氣的相對密度為4.19時,求N2的轉化率?
2NH3,當在某一溫度下達到化學平衡狀態,若測得平衡混合氣體對氫氣的相對密度為4.19時,求N2的轉化率? 科目:gzhx 來源: 題型:
科目:gzhx 來源:高考真題 題型:單選題
[ ]
科目:gzhx 來源: 題型:閱讀理解
(Ⅰ)氮是地球上含量豐富的一種元素,其單質及化合物在工農業生產、生活中有著重要作用。
(1)一定溫度下,在1L容積恒定的密閉容器中充入2molN2和8mol H2并發生反應。10min達平衡,測得氨氣的濃度為0.4mol/L,此時氮氣的轉化率為 。
(2)下圖是1mol NO2(g)和1molCO(g)反應生成1mol CO2(g)和1mol NO(g)過程中能量變化示意圖,請寫出該反應的熱化學方程式 。
(3)NH3(g)燃燒的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l)△H= -483.6 kJ/mol
N2(g)+2O2(g)==2NO2(g) △H=+67.8 kJ/mol
N2(g)+3H2(g)==2NH3(g) △H=-92.0 kJ/mol
請計算NH3(g)的燃燒熱 。
| 溫度 | 平衡濃度/ (mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 |
|
| T2 |
| 0.1 |
(4)將一定量的氨基甲酸銨固體置于某容積恒定的真空容器中,發生反應:
H2NCOONH4(s)![]() 2NH3(g)+CO2(g) 在不同溫度下,該反應平衡狀態部分數據見右表。下列說法正確的是
2NH3(g)+CO2(g) 在不同溫度下,該反應平衡狀態部分數據見右表。下列說法正確的是
A.若T2>T1,則該反應的ΔH<0
B.向容器中充入N2,H2NCOONH4質量增加
C.NH3體積分數不變時,說明該反應達到平衡
D.T1、T2時,H2NCOONH4轉化的Δn(T2)=2Δn(T1)
(Ⅱ)海水資源的利用具有廣闊前景。海水中主要離子的含量如下:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
|
|
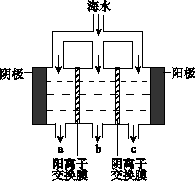 電滲析法淡化海水示意圖如下圖所示,其中陰(陽)離子交換膜僅允許陰(陽)離子通過。
電滲析法淡化海水示意圖如下圖所示,其中陰(陽)離子交換膜僅允許陰(陽)離子通過。
(1)陽極主要電極反應式是 。
(2)在陰極附近產生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的離子方程
式是 。
(3)淡水的出口為 (填“a”、“b”或“c”)。
科目:gzhx 來源: 題型:
科目:gzhx 來源:三點一測叢書 高中化學(選修)化學反應原理 江蘇版課標本 江蘇版課標本 題型:038
將7 mol N2和11 mol H2在適宜條件下按下式進行反應N2+3H2![]() 2NH3,當在某一溫度下達到化學平衡狀態,試解答:
2NH3,當在某一溫度下達到化學平衡狀態,試解答:
(1)若測得平衡混合氣體對空氣的相對密度為0.6時,求N2的轉化率.
(2)若測得平衡混合氣體對空氣的相對密度為0.47時,求N2的轉化率.
科目:gzhx 來源:安徽省蚌埠二中09-10學年下學期高二期中考試 題型:填空題
 2009年12月在哥本哈根召開的聯合國氣候變化大會上,“控制溫室氣體排放”成
2009年12月在哥本哈根召開的聯合國氣候變化大會上,“控制溫室氣體排放”成
為會議討論的焦點問題,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普
遍重視。
⑴目前工業上有一種方法是用CO2來生產燃料甲醇。為探
究反應原理,現進行如下實驗,在體積為1 L的密閉容器中,
充入3mol CO2和8mol H2,一定條件下發生反應:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
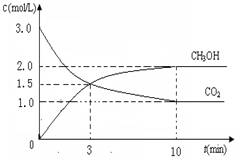
測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
①從反應開始到平衡,氫氣的平均反應速率v(H2)=___________mol/(L·min)
②CO2的轉化率為 。(保留一位小數)
③平衡常數K值為_____________;若升高溫度K值將________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高溫度 B.充入He(g),使體系壓強增大
C.將H2O(g)從體系中分離 D.再充入1mol CO2和3mol H2
⑵有人提出,可以設計反應2CO=2C+O2(△H>0、△S<0)來消除CO的污染。請你
判斷是否可行并說出理由:______________________________________________。
科目:gzhx 來源: 題型:
 2009年12月在哥本哈根召開的聯合國氣候變化大會上,“控制溫室氣體排放”成
2009年12月在哥本哈根召開的聯合國氣候變化大會上,“控制溫室氣體排放”成
為會議討論的焦點問題,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普
遍重視。
⑴目前工業上有一種方法是用CO2來生產燃料甲醇。為探
究反應原理,現進行如下實驗,在體積為1 L的密閉容器中,
充入3molCO2和8mol H2,一定條件下發生反應:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
①從反應開始到平衡,氫氣的平均反應速率v(H2)=___________mol/(L·min)
②CO2的轉化率為 。(保留一位小數)
③平衡常數K值為_____________;若升高溫度K值將________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高溫度 B.充入He(g),使體系壓強增大
C.將H2O(g)從體系中分離 D.再充入1mol CO2和3mol H2
⑵有人提出,可以設計反應2CO=2C+O2(△H>0、△S<0)來消除CO的污染。請你
判斷是否可行并說出理由:______________________________________________。
科目:gzhx 來源: 題型:
科目:gzhx 來源: 題型:
科目:gzhx 來源: 題型:
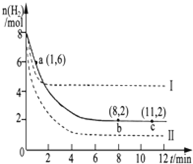 工業上可用CO2生產甲醇,反應為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).將6molCO2和8mol H2充入2L的密閉容器中,測得H2的物質的量隨時間變化如圖實線所示.圖中虛線表示僅改變某一反應條件時,H2物質的量隨時間的變化.下列說法正確的是( )
工業上可用CO2生產甲醇,反應為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).將6molCO2和8mol H2充入2L的密閉容器中,測得H2的物質的量隨時間變化如圖實線所示.圖中虛線表示僅改變某一反應條件時,H2物質的量隨時間的變化.下列說法正確的是( )| A、反應開始至a點時v(H2)=1mol?L-1?min-1 | B、若曲線I對應的條件改變是升高溫度,則該反應△H>0 | C、曲線II對應的條件改變是降低壓強 | D、保持溫度不變,若將平衡后的容器體積縮小至1L,重新達平衡時則2 mol?L-1<c(CH3OH)<8/3 mol?L-1 |
科目:gzhx 來源:2015屆河南省靈寶市高一下學期第二次檢測化學理科試卷(解析版) 題型:計算題
在一密閉的2L容器里裝有2molN2和6molH2 ,在一定條件下開始反應, 2min末測得容器中有1.2mol H2 ,請計算2min末NH3的濃度。
科目:gzhx 來源:2012-2013學年河南省靈寶市第三高級中學高一下學期第二次檢測化學理科試卷(帶解析) 題型:計算題
在一密閉的2L容器里裝有2molN2和6molH2 ,在一定條件下開始反應, 2min末測得容器中有1.2mol H2 ,請計算2min末NH3的濃度。
科目:gzhx 來源:2011年湖北省天門市高考化學模擬試卷(二)(解析版) 題型:選擇題
科目:gzhx 來源:不詳 題型:單選題
| A.①② | B.②④ | C.①③ | D.③④ |
科目:gzhx 來源:不詳 題型:單選題
| A.1項 | B.2項 | C.3項 | D.4項 |
科目:gzhx 來源:2013年吉林省延邊州安圖縣長白山一中高考化學二輪復習試卷(二)(解析版) 題型:選擇題