
科目: 來源: 題型:
【題目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有關操作、裝置、原理及對現象的表述正確的是
Fe2O3+SO2↑+SO3↑。下列有關操作、裝置、原理及對現象的表述正確的是
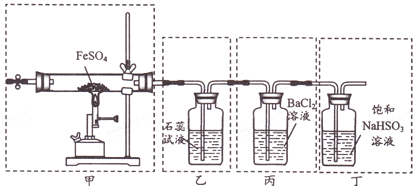
A. 用裝置甲高溫分解FeSO4,點燃酒精噴燈前應先向裝置內通一段時間N2
B. 用裝置乙可檢驗分解產生的SO2,現象是石蕊試液先變紅后褪色
C. 用裝置丙可檢驗分解產生的SO3,現象是產生白色沉淀
D. 用裝置丁可吸收尾氣,避免污染環境
查看答案和解析>>
科目: 來源: 題型:
【題目】能正確表示下列反應的離子方程式的是( )
A.向澄清石灰水中通入少量SO2氣體:Ca2++SO2=CaSO3↓
B.過量SO2氣體通入氫氧化鈉溶液中:SO2+OH-=![]()
C.SO2氣體通入溴水中:SO2+Br2+H2O=2H++2Br-+![]()
D.向氫硫酸中通入氯氣:S2-+Cl2=S↓+2Cl-
查看答案和解析>>
科目: 來源: 題型:
【題目】把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后有1.16 g白色沉淀,在所得的懸濁液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的體積V與生成沉淀的質量m的關系如圖所示,試回答:

(1)A點→B點反應的離子方程式為_______________________。
(2)原混合物中AlCl3的物質的量為______,NaOH的物質的量為_____。
(3)C點加入的HCl溶液體積為_____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨電極電解此溶液,當通電一段時間后,兩極均收集到22.4 L氣體(標準狀況),假定電解后溶液體積仍為500 mL,下列說法正確的是
A. 電解得到的Cu的物質的量為0.5 mol
B. 向電解后的溶液中加入98 g的Cu(OH)2可恢復為原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 電解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目: 來源: 題型:
【題目】配制960 mL 0.3mol/L NaOH溶液。具體如下:
(1)需稱取_________g NaOH。
(2)配制過程中除燒杯、托盤天平、玻璃棒,還需要用到主要玻璃儀器是__________。
(3)下列操作會使配制的溶液濃度偏低的是___________(填字母)。
A、配制氫氧化鈉溶液時,稱取已吸潮的氫氧化鈉固體
B、配制氫氧化鈉溶液時,容量瓶中有少量水
C、發現溶液液面超過刻度線,用吸管吸出少量水,使液面降至刻度線
D、定容時俯視容量瓶刻度線
查看答案和解析>>
科目: 來源: 題型:
【題目】某氣態烴0.5mol能與0.5molCl2完全加成,加成產物又可被3molCl2完全取代,則此氣態烴可能是
A.CH2=CH2B.CH3-CH=CH2
C.CH2=CHCH2CH3D.CH2=CH-CH=CH2
查看答案和解析>>
科目: 來源: 題型:
【題目】等體積、等物質的量濃度的硫酸、氫氧化鈉溶液分別放在甲、乙兩燒杯中,各加入等質量的鋁,生成氫氣的體積比為5:6,則甲、乙兩燒杯中的反應情況可能分別是
A. 甲、乙中都是鋁過量 B. 甲中鋁過量,乙中堿過量
C. 甲中酸過量,乙中鋁過量 D. 甲中酸過量,乙中堿過量
查看答案和解析>>
科目: 來源: 題型:
【題目】透明聚酯玻璃鋼可用于制造導彈的雷達罩和宇航員使用的氧氣瓶。制備它的一種配方中含有下列四種物質:
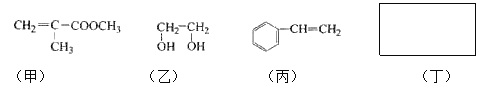
填寫下列空白:
(1)甲中不含氧原子的官能團是____________;下列試劑能與甲反應而褪色的是___________(填標號)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分異構體有多種,寫出其中一種不含甲基的羧酸的結構簡式:_______
(3)淀粉通過下列轉化可以得到乙(其中A—D均為有機物):

A的分子式是___________,試劑X可以是___________。
(4)已知: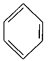 +RCl
+RCl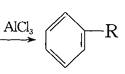 +HCl(-R為烴基)
+HCl(-R為烴基)
 +H2
+H2
利用上述信息,以苯、乙烯、氯化氫為原料經三步反應合成丙,其中屬于取代反應的化學方程式是 ______________ 。
(5)化合物丁僅含碳、氫、氧三種元素,相對分子質量為110。丁與FeCl3溶液作用現特征顏色,且丁分子中烴基上的一氯取代物只有一種。則丁的結構簡式為 ___________。
查看答案和解析>>
科目: 來源: 題型:
【題目】鈦被稱為繼鐵、鋁之后的第三金屬,請回答下列問題:
(1)金紅石(TiO2)是鈦的主要礦物之一,基態Ti原子價層電子的排布圖為_________,基態O原子電子占據最高能級的電子云輪廓圖為 __________形。
(2)以TiO2為原料可制得TiCl4,TiCl4的熔、沸點分別為205K、409K,均高于結構與其相似的CCl4,主要原因是 __________________。
(3)TiCl4可溶于濃鹽酸得H2[TiCl6],向溶液中加入NH4Cl濃溶液可析出黃色的(NH4)2[TiCl6]晶體。該晶體中微觀粒子之間的作用力有 ________。
A.離子鍵 B.共價鍵 C.分子間作用力 D.氫鍵 E.范德華力
(4)TiCl4可與CH3CH2OH、HCHO、CH3OCH3等有機小分子形成加合物。上述三種小分子中C原子的VSEPR模型不同于其他分子的是 _____,該分子中C的軌道雜化類型為________ 。
(5)TiO2與BaCO3一起熔融可制得鈦酸鋇。
①BaCO3中陰離子的立體構型為 ________。
②經X射線分析鑒定,鈦酸鋇的晶胞結構如下圖所示(Ti4+、Ba2+均與O2-相接觸),則鈦酸鋇的化學式為 _________。已知晶胞邊長為a pm,O2-的半徑為b pm,則Ti4+、Ba2+的半徑分別為____________pm、___________pm。

查看答案和解析>>
科目: 來源: 題型:
【題目】在373K時,把0.5molN2O4氣體通入體積為5L的真空密閉容器中,立即出現紅棕色。反應進行到2s時,NO2的濃度為0.02mol/L。在60s時,體系已達到平衡,此時容器內壓強為反應前的1.6倍。下列說法正確的是( )
A.前2s,以NO2濃度變化表示的平均反應速率為0.005mol·L-1·s-1
B.在2s時,體系內壓強為反應前的1.1倍
C.平衡時,體系內含N2O4的物質的量為0.25mol
D.平衡時,若往容器內充入氮氣,則可提高N2O4的轉化率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com