
【題目】某氣態烴0.5mol能與0.5molCl2完全加成,加成產物又可被3molCl2完全取代,則此氣態烴可能是
A.CH2=CH2B.CH3-CH=CH2
C.CH2=CHCH2CH3D.CH2=CH-CH=CH2
 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】已知:①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H1=﹣154 kJmol﹣1
②S(s)+O2(g)═SO2(g)△H2=﹣297 kJmol﹣1
③2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3
④2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H4
下列說法正確的是
A.△H3>△H4B.△H3=+143 kJmol﹣1
C.無法計算△H4的值D.H2S 燃燒熱為 1045 kJmol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣中的有害氣體主要有NO、碳氫化合物及CO,某校同學設計實驗將模擬汽車尾氣轉化為無害氣體。回答下列問題;

(1)為了配制模擬尾氣,甲組同學用上圖所示裝置分別制備NO、乙烯及CO三袋氣體。
①用裝置A制取NO,分液漏斗中盛放的是___(填試劑名稱)。
②用 (乙烯利)與NaOH溶液并用裝置B制取乙烯,反應生成乙烯的化學方程式為______(磷轉化為Na3 PO4)。
(乙烯利)與NaOH溶液并用裝置B制取乙烯,反應生成乙烯的化學方程式為______(磷轉化為Na3 PO4)。
③用H2 C2 O4與濃硫酸制取CO(化學方程式為H2C2O4 ![]() CO+CO2+H2O并提純,選用上圖裝置預制一袋干燥純凈的CO,各接口連接的順序為___→g(氣流從左至右),其中裝置D中盛放的藥品是___
CO+CO2+H2O并提純,選用上圖裝置預制一袋干燥純凈的CO,各接口連接的順序為___→g(氣流從左至右),其中裝置D中盛放的藥品是___
(2)乙組同學將甲組制得的氣體與空氣按適當比例混合形成模擬尾氣(NO,CO,C2 H4及空氣),按如圖所示 裝置進行尾氣轉化并檢驗。

①為檢驗催化反應后的氣體中是否有CO2生成和乙烯的殘留,G、H中盛放的試劑依次是_________(填標號)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模擬尾氣”前,需先將催化劑加熱到反應所需的溫度,其目的是___;寫出其中CO與NO完全轉化為無害氣體的化學方程式:___
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將除去表面氧化膜的Al、Cu片插入濃HNO3中組成原電池(圖1),測得原電池的電流強度(I)隨時間(t)的變化如圖2所示,下列說法正確的是

A. 0-t1時,原電池的負極是銅片
B. 0-t1時,正極的電極反應式是2H++2e-=H2↑
C. t1時刻,電流方向發生變化的原因是Al 在濃硝酸中發生鈍化,氧化膜阻止了Al進一步反應
D. tl時刻后,電子從鋁經過導線流向銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種分子式為C4H8O2的有機物的紅外光譜圖,則該有機物可能為
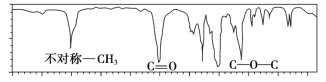
A.CH3COOCH2CH3B.CH3CH2CH2COOH
C.HCOOCH2CH2CH3D.(CH3)2CHCH2COOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有關操作、裝置、原理及對現象的表述正確的是
Fe2O3+SO2↑+SO3↑。下列有關操作、裝置、原理及對現象的表述正確的是
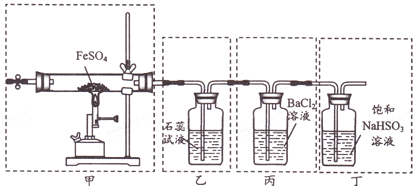
A. 用裝置甲高溫分解FeSO4,點燃酒精噴燈前應先向裝置內通一段時間N2
B. 用裝置乙可檢驗分解產生的SO2,現象是石蕊試液先變紅后褪色
C. 用裝置丙可檢驗分解產生的SO3,現象是產生白色沉淀
D. 用裝置丁可吸收尾氣,避免污染環境
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)標準狀況下,1.92 g某氣體的體積為672 mL,則此氣體的相對分子質量為_____。
(2)在25 ℃、101 kPa的條件下,同質量的CH4和A氣體的體積之比是15∶8,則A的摩爾質量為________________。
(3)兩個相同容積的密閉容器X、Y,在25 ℃下,X中充入a g A氣體,Y中充入a g CH4氣體,X與Y內的壓強之比是4∶11,則A的摩爾質量為_____________。
(4)19 g某二價金屬的氯化物RCl2中含有0.4 mol的Cl-,則R的相對原子質量為__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,則溶液中SO42-的物質的量濃度為___________mol·L-1。
(6)在無土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某營養液,若用KCl、NH4Cl、(NH4)2SO4配制,則需KCl、NH4Cl的物質的量分別為________、________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究處理NOx、SO2,對環境保護有著重要的意義。回答下列問題:
(1)SO2的排放主要來自于煤的燃燒,工業上常用氨水吸收法處理尾氣中的SO2。已知吸收過程中相關反應的熱化學方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,則反應 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要來自于汽車尾氣,有人利用反應C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭對NO進行吸附。在恒壓密閉容器中加入足量的活性炭和一定量的NO氣體,測得NO的轉化率 α(NO)隨溫度的變化如圖所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭對NO進行吸附。在恒壓密閉容器中加入足量的活性炭和一定量的NO氣體,測得NO的轉化率 α(NO)隨溫度的變化如圖所示:
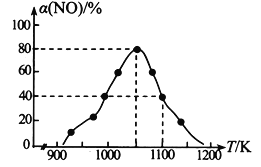
①由圖可知,1050K前反應中NO的轉化率隨溫度升高而增大,原因是_________________________; 在1100K 時,CO2的體積分數為______。
②用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(記作Kp)。在1050K、1.1×106Pa 時,該反應的化學平衡常數Kp=________(已知:氣體分壓=氣體總壓×體積分數)。
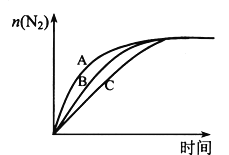
(3)在高效催化劑的作用下用CH4還原NO2,也可消除氮氧化物的污染。在相同條件下,選用A、B、C三種不同催化劑進行反應,生成 N2的物質的量與時間變化關系如圖所示,其中活化能最小的是_________(填字母標號)。
(4)在汽車尾氣的凈化裝置中 CO和NO發生反應:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。實驗測得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆為速率常數,只與溫度有關)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。實驗測得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆為速率常數,只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數_____(填" >”、“< ”或“=”) k逆增大的倍數。
②若在1L 的密閉容器中充入1 mol CO和1 mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則![]() =_____(保留2位有效數字)。
=_____(保留2位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是合成巴比妥類鎮靜藥物的中間體,一種以丙烯為原料合成H的路線如下:
![]()
已知:①A、B、C均可發生銀鏡反應。
②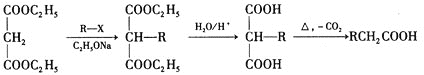
請回答下列問題:
(1)A的化學名稱是___,B中官能團的名稱是___。
(2)由C生成D中反應i的化學方程式為___。
(3)E的結構簡式為___,由E生成F的反應類型是___。
(4)與H互為同分異構體且與C互為同系物的有機物有___種,其中核磁共振氫譜有3組峰的結構簡式為___(任寫一種)。
(5)設計由乙烯、乙醇鈉和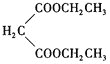 為原料制備2-乙基丁酸的合成路線
為原料制備2-乙基丁酸的合成路線![]() 無機試劑任選
無機試劑任選![]() ___。
___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com