
【題目】鈦被稱為繼鐵、鋁之后的第三金屬,請回答下列問題:
(1)金紅石(TiO2)是鈦的主要礦物之一,基態Ti原子價層電子的排布圖為_________,基態O原子電子占據最高能級的電子云輪廓圖為 __________形。
(2)以TiO2為原料可制得TiCl4,TiCl4的熔、沸點分別為205K、409K,均高于結構與其相似的CCl4,主要原因是 __________________。
(3)TiCl4可溶于濃鹽酸得H2[TiCl6],向溶液中加入NH4Cl濃溶液可析出黃色的(NH4)2[TiCl6]晶體。該晶體中微觀粒子之間的作用力有 ________。
A.離子鍵 B.共價鍵 C.分子間作用力 D.氫鍵 E.范德華力
(4)TiCl4可與CH3CH2OH、HCHO、CH3OCH3等有機小分子形成加合物。上述三種小分子中C原子的VSEPR模型不同于其他分子的是 _____,該分子中C的軌道雜化類型為________ 。
(5)TiO2與BaCO3一起熔融可制得鈦酸鋇。
①BaCO3中陰離子的立體構型為 ________。
②經X射線分析鑒定,鈦酸鋇的晶胞結構如下圖所示(Ti4+、Ba2+均與O2-相接觸),則鈦酸鋇的化學式為 _________。已知晶胞邊長為a pm,O2-的半徑為b pm,則Ti4+、Ba2+的半徑分別為____________pm、___________pm。

【答案】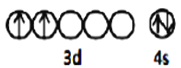 啞鈴型 TiCl4的相對分子質量大于CCl4,分子間作用力更大 AB HCHO sp2 平面三角形 BaTiO3
啞鈴型 TiCl4的相對分子質量大于CCl4,分子間作用力更大 AB HCHO sp2 平面三角形 BaTiO3 ![]()
![]()
【解析】
(1)根據元素核外電子排布規律書寫電子排布式,根據電子排布式判斷最高能級及電子云輪廓;
(2)分子晶體的熔沸點與分子間作用力有關,根據相對分子質量分析判斷;
(3)結合晶體轉化反應過程,和物質類別判斷分析化學鍵的種類;
(4)根據有機物中碳原子的成鍵方式,判斷空間構型,進而判斷碳原子雜化方式;
(5)①應用雜化軌道理論計算中心原子的價電子對數確定雜化方式分析確定立體構型;
②結合晶胞圖示計算晶胞中各原子的個數書寫其分子式,再結合晶胞微粒的相互位置關系計算微粒的半徑。
(1) Ti為38號元素,基態鈦原子核外電子排布式為:[Ar]3d24s2,則價層電子排布圖為![]() ;基態O原子核外電子排布式為1s22s22p4,最高能級為p,其電子云輪廓為啞鈴型;
;基態O原子核外電子排布式為1s22s22p4,最高能級為p,其電子云輪廓為啞鈴型;
(2) TiCl4的熔、沸點分別為205K、409K,與CCl4結構相似,都屬于分子晶體,分子晶體的熔沸點與分子間作用力有關,相對分子質量越大,分子間作用力越大,熔沸點越高,TiCl4的相對分子質量大于CCl4,分子間作用力更大;
(3)根據轉化過程TiCl4可溶于濃鹽酸得H2[TiCl6],可看做形成一種酸,所有的酸都屬于共價化合物,向溶液中加入NH4Cl濃溶液可析出黃色的(NH4)2[TiCl6]晶體,可看做酸跟鹽反應生成(NH4)2[TiCl6],產物中含有銨根離子,根據以上分析,(NH4)2[TiCl6]晶體中含有共價鍵和離子鍵,故答案選AB;
(4) CH3CH2OH和CH3OCH3中的碳原子都是以單鍵形式成鍵,結構與甲烷相似,都是四面體結構,HCHO的碳原子含有碳氧雙鍵,分子中所有在同一平面,為平面三角形,根據構型可知,三個分子中C原子的VSEPR模型不同于其他分子的是HCHO,根據構型可得,該分子中C的軌道雜化類型為sp2雜化;
(5)①BaCO3中陰離子為CO32-,中心原子為碳原子,其價層電子對數=3+![]() =3,碳原子為sp2雜化,該陰離子由4個原子構成,則立體構型為平面三角形;
=3,碳原子為sp2雜化,該陰離子由4個原子構成,則立體構型為平面三角形;
②根據晶胞圖示,Ti位于晶胞的頂點,Ti的數目=8×![]() =1,Ba原子位于晶胞的內部,數目為1,分析計算分子式和粒子半徑;O原子位于晶胞的棱上,其數目=12×
=1,Ba原子位于晶胞的內部,數目為1,分析計算分子式和粒子半徑;O原子位于晶胞的棱上,其數目=12×![]() =3,則則鈦酸鋇的化學式為BaTiO3;已知晶胞邊長為a pm,O2-的半徑為bpm,根據圖示,晶胞邊長= 2r(Ti4+)+2r(O2-)=apm,則r(Ti4+)=
=3,則則鈦酸鋇的化學式為BaTiO3;已知晶胞邊長為a pm,O2-的半徑為bpm,根據圖示,晶胞邊長= 2r(Ti4+)+2r(O2-)=apm,則r(Ti4+)=![]() pm;晶胞面對角線的長度=2r(O2-)+2r(Ba2+)=
pm;晶胞面對角線的長度=2r(O2-)+2r(Ba2+)=![]() a pm,r(Ba2+)=
a pm,r(Ba2+)=![]() pm。
pm。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列各組熱化學方程式中,化學反應的△H 前者小于后者的是
①C(s)+O2(g)═CO2(g)△H1 C(s)+![]() O2═CO(g)△H2
O2═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H3 S(s)+O2(g)═SO2(g)△H4
③2H2(g)+O2(g)═2H2O(l)△H5 H2(g)+![]() O2(g)═H2O(l)△H6
O2(g)═H2O(l)△H6
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8
A.①④B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】多尺度復雜化學系統模型可以用量子化學計算小區間內(如生物固氮時固氮酶中)的化學反應。
(1)固氮酶有鐵蛋白和鉬鐵蛋白兩種,它們不僅能夠催化N2還原成NH3,還能將環境底物乙炔催化還原成乙烯。
①乙炔是__________(填“非極性”或“極性”)分子。
②碳負離子CH3-的立體構型為____________。
③根據等電子原理,NO+的電子式為________________。
(2)釩可用于合成電池電極,也可用于人工合成二價的釩固氮酶(結構如圖a)。
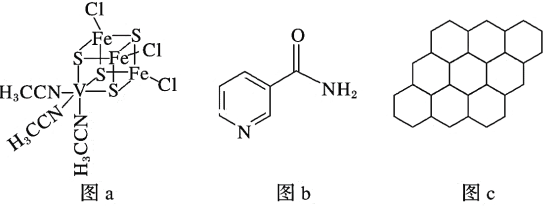
①V2+基態時核外電子排布式為____________________________________________。
②釩固氮酶中釩的配位原子有_____________________________(填元素符號)。
(3)煙酰胺(結構如圖b)可用于合成光合輔酶NADPH,煙酰胺分子中氮原子的雜化軌道類型有_______________________,1 mol該分子中含σ鍵的數目為________。
(4)12 g石墨烯(結構如圖c)中含有的正六邊形數目約為________;請你預測硅是否容易形成類似石墨烯的結構,并說明理由:___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為我國圓明園獸首銅像—兔首和鼠首,看上去仍熠熠生輝。下列對其原因的分析最可能的是( )

A.它們表面的銅綠已用酸性溶液洗去B.利用電鍍原理在其表面鍍了一層耐腐蝕的黃金
C.銅的活動性很弱,與空氣成分不反應D.它們是含一定比例金、銀、錫、鋅的銅合金
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸生產中存在爐氣轉化反應:2SO2(g)+O2(g)![]() 2SO3(g)。研究發現,SO3的體積分數隨溫度(T)的變化如曲線I所示。下列判斷正確的是
2SO3(g)。研究發現,SO3的體積分數隨溫度(T)的變化如曲線I所示。下列判斷正確的是

A.該反應的正反應為吸熱反應
B.反應達到B點時,2υ正(O2)=υ逆(SO3)
C.曲線I上A、C兩點反應速率的關系:υA>υC
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化劑時的曲線,則II是Fe2O3作催化劑時的曲線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨電極電解此溶液,當通電一段時間后,兩極均收集到22.4 L氣體(標準狀況),假定電解后溶液體積仍為500 mL,下列說法正確的是
A. 電解得到的Cu的物質的量為0.5 mol
B. 向電解后的溶液中加入98 g的Cu(OH)2可恢復為原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 電解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(1)下列六種生活中常見物質:
①食鹽 ②食用油 ③靑霉素 ④雞蛋 ⑤西紅柿 ⑥塑料
按要求用物質序號填空:
作調味劑的是___________;作抗生素的是___________;富含蛋白質的是___________;富含維生素的是___________;富含油脂的是___________;屬于合成材料的是___________。
(2)一個體重50 kg的健康人,體內約含有2 g鐵,這2 g鐵在人體內不是以單質的形式存在,而是以Fe2+和Fe3+的形式存在。正二價鐵離子易被吸收,給貧血者補充鐵時,應給予含Fe2+的亞鐵鹽,如硫酸亞鐵。服用維生素C,可使食物中的Fe3+還原成Fe2+, 有利于人體吸收。
i.在人體中進行Fe2+ ![]() Fe3+的轉化時,①中的Fe2+作________ (填“氧化劑”或“還原劑”),②中的Fe3+作________ (填“氧化劑”或“還原劑”)。
Fe3+的轉化時,①中的Fe2+作________ (填“氧化劑”或“還原劑”),②中的Fe3+作________ (填“氧化劑”或“還原劑”)。
ii.服用維生索C,可使食物中的Fe3+還原成Fe2+這句話指出,維生素C在這一反應中作 ____________(填“氧化劑”或“還原劑”)
iii.市場出售的某種麥片中含有微量的顆粒細小的還原鐵粉,這些鐵粉在人體胃酸 (HC1)的作用下轉化成亞鐵鹽。此反應的離子方程式為___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】建造艦船需要大量的新型材料,艦船的甲板也要耐高溫且外殼要耐腐蝕,而鎳鉻鐵合金就是具有高強度、耐高溫、耐腐蝕等優良性能的特種鋼,這類特種鋼中含有碳、硅、氧、氮、磷等元素。
(1)保鉻鋼抗腐蝕性能強,![]() 基態原子的價電子排布_________,為鉻元素在周期表中_________區。
基態原子的價電子排布_________,為鉻元素在周期表中_________區。
(2)![]() 能形成多種配離子,如
能形成多種配離子,如![]() 、
、![]() 和
和![]() 等,
等,![]() 中心原子的配位數是_________,與
中心原子的配位數是_________,與![]() 互為等電子體的分子為_________。
互為等電子體的分子為_________。
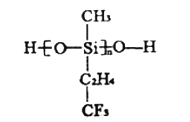
(3)艦船甲板涂有一層耐高溫的材料聚硅氧烷結構如圖所示,其中![]() 原子雜化方式為________雜化。
原子雜化方式為________雜化。
(4)碳和硅可化合成碳化硅,![]() 晶體具有類似金剛石的結構,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔點低于金剛石,原因是_________。
晶體具有類似金剛石的結構,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔點低于金剛石,原因是_________。
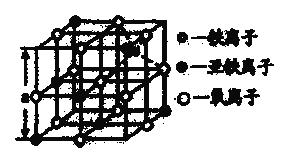
(5)鐵的氧化物之一是![]() ,從
,從![]() 中取出的能體現其晶體結構的一個立方體,則晶體中的離子是否構成了面心立方最密堆積?________(填“是”或“否”);該立方體是不是
中取出的能體現其晶體結構的一個立方體,則晶體中的離子是否構成了面心立方最密堆積?________(填“是”或“否”);該立方體是不是![]() 的晶胞?_________(填“是”或“否”);立方體中鐵離子處于氧離子圍成的_________(填空間結構)空隙;根據上圖計算
的晶胞?_________(填“是”或“否”);立方體中鐵離子處于氧離子圍成的_________(填空間結構)空隙;根據上圖計算![]() 晶體的密度為_________
晶體的密度為_________![]() 。(圖
。(圖![]() ,計算結果保留兩位有效數字)
,計算結果保留兩位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某短周期非金屬元素的原子核外最外層電子數是次外層電子數的一半,該元素
A. 在自然界中只以化合態的形式存在
B. 單質常用作左半導體材料和光導纖維
C. 最高價氧化物不與酸反應
D. 氣態氫化物比甲烷穩定
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com