
科目: 來源: 題型:
【題目】2020年3月29日,全球新能源汽車領導者比亞迪宣布正式推出“刀片電池”。“刀片電池”是將傳統磷酸鐵鋰電池電芯加長,使單個電芯形狀扁平、窄小,再通過多個“刀片”捆扎形成模組,通過少數幾個大模組的組合成電池。“刀片電池”放電時結構如下,正極反應為:Li1-xFePO4+xe-+xLi+=LiFePO4,下列說法錯誤的是( )
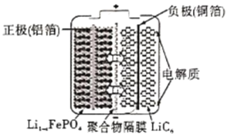
A.“刀片電池”和三元鋰電池(鐐鉆錠酸鋰電池)相比幾乎沒有污染
B.放電時,負極反應為LiC6-xe-=xLi++Li1-xC6
C.充電時,鋰離子在陰極脫嵌;放電時,鋰離子在正極脫嵌
D.該電池維持電流強度4.825A,工作10分鐘,理論上正極增加重量0.21g(已知F=96500C/mol)
查看答案和解析>>
科目: 來源: 題型:
【題目】25 ℃,101 k Pa時,強酸與強堿的稀溶液發生中和反應的中和熱為57.3 kJ/mol,辛烷的燃燒熱為5518 kJ/mol。下列熱化學方程式書寫正確的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目: 來源: 題型:
【題目】向20mL0.1mol/L的NaHCO3溶液中滴加0.1mol/L氨水(已知室溫下H2CO3Ka1=4.2×10-7,Ka2=5.6x10-11),NH3H2O(Kb=1.78×10-5),下列說法錯誤的是( )
A.0.1mol/L的NaHCO3溶液中:c(OH-)+c(CO![]() )=c(H2CO3)+c(H+)
)=c(H2CO3)+c(H+)
B.無論滴加多少氨水,溶液中一定滿足:c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)=c(Na+)
)+c(H2CO3)=c(Na+)
C.當滴入10mL氨水時,發生反應的離子方程式為:HCO![]() +NH3·H2O=CO
+NH3·H2O=CO![]() +NH
+NH![]() +H2O,該反應的平衡常數約為0.1
+H2O,該反應的平衡常數約為0.1
D.當滴入20mL NH3·H2O時,c(Na+)=c(NH![]() )+c(NH3·H2O)=0.1mol/L
)+c(NH3·H2O)=0.1mol/L
查看答案和解析>>
科目: 來源: 題型:
【題目】對于可逆反應mA(s)+nB(g)![]() eC(g)+fD(g),當其他條件不變時,C的體積分數[φ(C)]在不同溫度(T)和不同壓強(p)下隨時間(t)的變化關系如圖所示。下列敘述正確的是( )
eC(g)+fD(g),當其他條件不變時,C的體積分數[φ(C)]在不同溫度(T)和不同壓強(p)下隨時間(t)的變化關系如圖所示。下列敘述正確的是( )
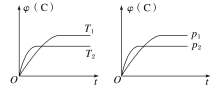
A.達到平衡后,若使用催化劑,C的體積分數將增大
B.該反應的ΔH<0
C.化學方程式中,n>e+f
D.達到平衡后,增加A的質量有利于化學平衡向正反應方向移動
查看答案和解析>>
科目: 來源: 題型:
【題目】有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液時,生成沉淀的質量w(g)和Ba(OH)2溶液的體積V(mL)的關系如圖所示(C 點混合液呈中性)。則原混合液中H2SO4的物質的量濃度為__mol·L-1,HNO3的物質的量濃度為__mol·L-1。

查看答案和解析>>
科目: 來源: 題型:
【題目】某小組為研究電化學原理,設計如圖裝置.下列敘述不正確的是

A. a和b不連接時,鐵片上會有金屬銅析出
B. a和b用導線連接時,銅片上發生的反應為:Cu2++2e-=Cu
C. 無論a和b是否連接,鐵片均會溶解
D. a和b用導線連接后,Fe片上發生還原反應,溶液中的Cu2+向銅電極移動
查看答案和解析>>
科目: 來源: 題型:
【題目】向27.2 g Cu和Cu2O的混合物中加入某濃度的稀HNO3500 mL,反應過程中產生的氣體只有NO。固體完全溶解后,在所得溶液(金屬陽離子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金屬離子恰好完全沉淀,此時溶液呈中性,所得沉淀質量為39.2 g。
(1)Cu與稀HNO3反應的離子方程式為__。
(2)Cu與Cu2O 的物質的量之比為__。
(3)HNO3的物質的量濃度為__mol·L-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于阿伏伽德羅常數(NA)說法正確的是( )
A.lLpH=l的H3PO4溶液中,含有0.1NA個H+
B.在6.0gNaHSO4晶體中,所含離子數目為0.15NA
C.加熱條件下,1molFe投入足量的濃硫酸中,生成NA個SO2分子
D.8.4g環戊烯醇![]() ,含有0.8NA個極性鍵
,含有0.8NA個極性鍵
查看答案和解析>>
科目: 來源: 題型:
【題目】在容積一定的密閉容器中,置入一定量的NO(g)和足量C(s),發生反應C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡狀態時NO(g)的物質的量濃度[NO]與溫度T的關系如圖所示。則下列說法中正確的是( )
CO2(g)+N2(g),平衡狀態時NO(g)的物質的量濃度[NO]與溫度T的關系如圖所示。則下列說法中正確的是( )

A. 該反應的ΔH>0
B. 若該反應在T1、T2時的平衡常數分別為K1、K2,則K1<K2
C. 在T2時,若反應體系處于狀態D,則此時一定有v正<v逆
D. 在T3時,若混合氣體的密度不再變化,則可以判斷反應達到平衡狀態C
查看答案和解析>>
科目: 來源: 題型:
【題目】在一定溫度下,10mL 0.40mol/L H2O2 溶液發生催化分解。不同時刻測得生成O2的體積(已折算為標準狀況)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列敘述不正確的是(溶液體積變化忽略不計)
A.0~6min的平均反應速率:υ(H2O2)=3.3×10-2mol/(L·min)
B.6~10min的平均反應速率:υ(H2O2)<3.3×10-2mol/(L·min)
C.反應到6min時,c(H2O2)=0.30mol/L
D.反應到6min時,H2O2 分解了50%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com