
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題


 ),試寫出該兩步反應對應的化學方程
),試寫出該兩步反應對應的化學方程 ;
;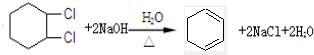 .
.查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目: 來源: 題型:解答題

| 容器 | 反應物投入的量 | 反應物的 轉化率 | CH3OH的濃度 | 能量變化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ熱量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ熱量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ熱量 |
查看答案和解析>>
科目: 來源: 題型:解答題
 甲醇是重要的化工原料,在日常生活中有著廣泛的應用.
甲醇是重要的化工原料,在日常生活中有著廣泛的應用.| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com