


 ),試寫出該兩步反應對應的化學方程
),試寫出該兩步反應對應的化學方程 ;
;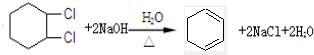 .
. 分析 本題根據醇的消去反應原理,利用環己醇制備環己烯的實驗操作流程,涉及制備、分離提純及實驗的綜合評價,制備過程中反應混合液加熱時為了防暴沸要加入碎瓷片,產物收集里要冷凝使之液化,防揮發,粗產品分離時涉及到分液和蒸餾二種分離操作,另外還探究了產品純度分析,
(1)①根據制乙烯實驗的知識,發生裝置A中碎瓷片的作用是防止暴沸,由于生成的環己烯的沸點為83℃,要得到液態環己烯,導管B除了導氣外還具有冷凝作用,便于環己烯冷凝;
②冰水浴的目的是降低環己烯蒸氣的溫度,使其液化;
(2)①環己烯不溶于氯化鈉溶液,且密度比水小,分層后環己烯在上層,由于分液后環己烯粗品中還含有少量的酸和環己醇,提純產物時用c(Na2CO3溶液)洗滌可除去酸;
②蒸餾時為了增加冷凝效果,冷卻水從下口(g)進入;
③根據表中數據可知,餾分環己烯的沸點為83℃;
a、若提前收集,產品中混有雜質,實際產量高于理論產量;
b、制取的環己烯物質的量增大,實驗制得的環己烯精品質量高于理論產量;
c、粗產品中混有環己醇,導致測定消耗的環己醇量增大,制得的環己烯精品質量低于理論產量;
(3)根據混合物沒有固定的沸點,而純凈物有固定的沸點,據此可判斷產品的純度,還可以根據環己醇與環己烯的結構差異來鑒別;
(4)用環己烯經兩步反應合成1,3-環己二烯,可結合烯烴的加成和鹵代烴的消去反應原理來分析.
解答 解:(1)①根據制乙烯實驗的知識,發生裝置A中碎瓷片的作用是防止暴沸,由于生成的環己烯的沸點為83℃,要得到液態環己烯,導管B除了導氣外還具有冷凝作用,便于環己烯冷凝.故答案為:防止暴沸;冷凝;
②冰水浴的目的是降低環己烯蒸氣的溫度,使其液化,故答案為:防止環己烯揮發.
(2)①環己烯是烴類,不溶于氯化鈉溶液,且密度比水小,振蕩、靜置、分層后環己烯在上層,由于分液后環己烯粗品中還含有少量的酸和環己醇,聯想:制備乙酸乙酯提純產物時用c(飽和Na2CO3溶液)洗滌可除去酸;故答案為:上層;c;
②蒸餾裝置要有冷凝管,為了增加冷凝效果,冷卻水的方向應該和蒸汽的流向相反,冷卻水從下口(g)進入,故答案為:g;
③根據表中數據可知,餾分環己烯的沸點為83℃,故收集產品應控制溫度在83℃左右;
a、蒸餾時從70℃開始收集產品,提前收集,產品中混有雜質,實際產量高于理論產量,故a錯誤;
b、環己醇實際用量多了,制取的環己烯的物質的量增大,實驗制得的環己烯精品質量高于理論產量,故b錯誤;
c、若粗產品中混有環己醇,導致測定消耗的環己醇量增大,制得的環己烯精品質量低于理論產量,故c正確,故選c;
故答案為:83℃;c;
(3)區別粗品與精品可加入金屬鈉,觀察是否有氣體產生,若無氣體,則是精品,另外根據混合物沒有固定的沸點,而純凈物有固定的沸點,通過測定環己烯粗品和環己烯精品的沸點,也可判斷產品的純度,故答案為:bc;
(4)環己烯先與氯氣發生加成反應,再與氫氧化鈉的混合溶液混合加熱,利用鹵代烴的消去反應最后可得1,3-環己二烯,發生反應的化學方程式為
環己烯和水發生加成反應生成環己醇,化學方程式為 、
、 ,故答案為:
,故答案為: 、
、 .
.
點評 本題考查了以環己醇制備環己烯的實驗方法,綜合考查了物質的分離方法,冷凝,產量的分析等,難度適中,考查學生解決實際問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | KCl溶液與Na2CO3溶液反應:2K++CO32-═K2CO3 | |
| B. | 氧化鎂與鹽酸反應:MgO+2H+═Mg2++H2O | |
| C. | 碳酸氫鈉與鹽酸反應:CO32-+2H+═CO2↑+H2O | |
| D. | 碳酸鈉與氯化鈣反應:Na2CO3+Ca2+═CaCO3↓+2Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其電子的自旋方向共有2種.比較兩種同主族非金屬元素形成的單質的氧化性(用化學方程式表示)2H2S+O2=2S↓+2H2O
,其電子的自旋方向共有2種.比較兩種同主族非金屬元素形成的單質的氧化性(用化學方程式表示)2H2S+O2=2S↓+2H2O查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 溴主要以Br-形式存在于海水中,海水呈弱堿性.工業上制備的Br2的操作步驟為:
溴主要以Br-形式存在于海水中,海水呈弱堿性.工業上制備的Br2的操作步驟為:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物質的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反應物的平衡轉化率% | 80 | a1 | a2 | a3 | |
| A. | 該溫度下,平衡常數的值為400 | B. | 平衡時,丙中c(SO3)是甲中的2倍 | ||
| C. | 平衡時,a3>a1 | D. | 乙中SO3的平衡轉化率為a1=20% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| AX | BX | AY | BY |
| pH=7,c(X-)=1mol/L | pH=4 | pH=6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱溶有SO2的品紅溶液 | |
| B. | 將HCl通入NaAlO2溶液中 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸 | |
| D. | 向碳酸氫鈉溶液中滴加氫氧化鈉溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com