
| A. | KCl溶液與Na2CO3溶液反應:2K++CO32-═K2CO3 | |
| B. | 氧化鎂與鹽酸反應:MgO+2H+═Mg2++H2O | |
| C. | 碳酸氫鈉與鹽酸反應:CO32-+2H+═CO2↑+H2O | |
| D. | 碳酸鈉與氯化鈣反應:Na2CO3+Ca2+═CaCO3↓+2Na+ |
分析 A.氯化鉀與碳酸鈉不發生反應;
B.氧化鎂與鹽酸反應生成氯化鎂和水;
C.碳酸氫鈉在溶液中電離出碳酸氫根離子,碳酸氫根離子不能拆開;
D.碳酸鈉為易溶物,離子方程式中碳酸鈉應該拆開.
解答 解:A.KCl溶液與Na2CO3溶液不滿足離子反應發生條件,無法寫出離子方程式,故A錯誤;
B.氧化鎂與鹽酸反應的離子方程式為:MgO+2H+═Mg2++H2O,故B正確;
C.碳酸氫鈉與鹽酸反應生成氯化鈉、二氧化碳氣體和水,正確的離子方程式為:HCO3-+H+═CO2↑+H2O,故C錯誤;
D.碳酸鈉與氯化鈣反應生成碳酸鈣沉淀,正確的離子方程式為:CO32-+Ca2+═CaCO3↓,故D錯誤;
故選B.
點評 本題考查了離子方程式的判斷,題目難度中等,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合原化學方程式等.


 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:解答題
 如圖甲和乙是某學校王老師制備NH3并進行性質實驗時的改進裝置:
如圖甲和乙是某學校王老師制備NH3并進行性質實驗時的改進裝置:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L | B. | 0.4mol/L | C. | 0.3mol/L | D. | 0.15mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氣化和液化是使煤變成清潔能源的有效途徑,煤的氣化的主要反應是C+H2O(g)$\frac{\underline{\;高溫\;}}{\;}$CO+H2,CO和H2的混合氣體是合成多種有機物的原料氣,研究由CO和H2合成有機物的化學稱為一碳化學,如圖是合成某些物質的路線圖.
氣化和液化是使煤變成清潔能源的有效途徑,煤的氣化的主要反應是C+H2O(g)$\frac{\underline{\;高溫\;}}{\;}$CO+H2,CO和H2的混合氣體是合成多種有機物的原料氣,研究由CO和H2合成有機物的化學稱為一碳化學,如圖是合成某些物質的路線圖. +2H2O;②A→B:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
+2H2O;②A→B:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對有氣體參加的化學反應,通過減小體積增大體系壓強,可使單位體積內活化分子數增加,因而反應速率增大 | |
| B. | 升高溫度,主要是因為分子運動加劇,碰撞頻率提高,因而反應速率增大 | |
| C. | 活化分子之間發生的碰撞一定為有效碰撞 | |
| D. | 加入適宜的催化劑,可使活化能增大,從而加快反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 ),試寫出該兩步反應對應的化學方程
),試寫出該兩步反應對應的化學方程 ;
;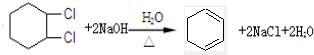 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com