

分析 (1)儀器a為球形干燥管,作用是干燥氧氣和氨氣的混合氣體,應選用堿性干燥劑;
(2)移去酒精燈,Cr2O3固體保持紅熱說明反應放熱;
裝置C中發生反應的化學反應是氨氣的催化氧化反應生成一氧化氮和水;
(3)無水氯化鈣是常用的干燥劑,同時氯化鈣可以與NH3反應生成八氨合氯化鈣;氫氧化鈉溶液可以吸收酸性氣體;
(4)一氧化氮與空氣中的氧氣反應生成二氧化氮;
(5)二氧化氮氣體與水反應生成硝酸,硝酸遇到石蕊試液變紅色;
(6)根據氫氧化鈉的物質的量計算硝酸的濃度.
解答 解:(1)儀器a為球形干燥管,作用是干燥氧氣和氨氣的混合氣體,應選用堿性干燥劑堿石灰,故答案為:球形干燥管;堿石灰;
(2)裝置C中發生反應的化學反應是氨氣的催化氧化反應生成一氧化氮和水,反應的化學方程式為:4NH3+5O2$\frac{\underline{\;Cr_{2}O_{3}\;}}{△}$4NO+6H2O;
移去酒精燈,Cr2O3固體保持紅熱說明反應放熱,
故答案為:該反應為放熱反應;4NH3+5O2$\frac{\underline{\;Cr_{2}O_{3}\;}}{△}$4NO+6H2O;
(3)氯化鈣可以與NH3反應生成八氨合氯化鈣,無水氯化鈣是常用的干燥劑,故可以吸收氨氣和水蒸氣;裝置G中盛放的是氫氧化鈉溶液,可以吸收尾氣,防治污染環境;
故答案為:除去氨氣和水蒸氣;吸收尾氣;
(4)無色的一氧化氮與空氣中的氧氣反應生成紅棕色的二氧化氮,故答案為:氣體變為紅棕色;
(5)二氧化氮氣體與水反應生成硝酸,硝酸遇到石蕊試液變紅色,故證明有HNO3生成的操作是:取少量F中的液體于試管中,滴加幾滴紫色石蕊試液,溶液變紅,證明有HNO3生產,
故答案為:取少量F中的液體于試管中,滴加幾滴紫色石蕊試液,溶液變紅,證明有HNO3生產;
(6)反應制得的硝酸的濃度為$\frac{0.100mol×25ml}{20ml}$×$\frac{1000ml}{20ml}$=6.25mol/L,故答案為:6.25.
點評 本題以氨氧化法制取硝酸為載體考查物質制備的實驗探究和物質性質的分析應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 將氯氣溶于水,須通入倒置并邊緣沒入水中的漏斗 | |
| B. | 粉碎結塊的硝酸銨,可將藥品放入研體中輕輕敲碎 | |
| C. | 洗滌做過銀鏡反應的試管,先用濃硝酸洗滌,再用自來水沖洗 | |
| D. | 玻璃導管與橡皮導管連接,可使玻璃導管蘸水后邊旋轉邊插入橡皮導管 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
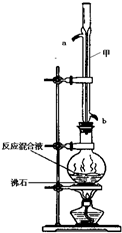 苯甲酸甲酯是一種重要的工業原料,某化學小組采用如圖裝置,以苯甲酸、甲醇為原料制取苯甲酸甲酯.有關物質的物理性質見下表所示:
苯甲酸甲酯是一種重要的工業原料,某化學小組采用如圖裝置,以苯甲酸、甲醇為原料制取苯甲酸甲酯.有關物質的物理性質見下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔點/℃ | 122.4 | -97 | -12.3 |
| 沸點/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |

| 物質 | CO2 | CH4 | CO | H2 |
| 濃度(mol•L-1) | 1 | 1 | 1 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸化學式 | H2SO3 | H2CO3 |
| 電離常數(25℃) | Ka1=1.3×10-2 Ka2=6.3×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 |
| A. | c(HCO3-)<c(CO32-) | |
| B. | 兩溶液都能使酸性高錳酸鉀溶液褪色 | |
| C. | c(HCO3-)>c(HSO3-) | |
| D. | c(CO32-)+c(HCO3-)=c(SO32-)+c(HSO3-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醋酸的電離度 | B. | 溶液的導電性 | ||
| C. | 溶液的c(OH-) | D. | 溶液中$\frac{[C{H}_{3}COO].[{H}^{+}]}{[C{H}_{3}COOH]}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| Z | M | R | Q | |
| 原子半徑/nm | 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合價 | -2 | -1,+7 | +3 |
| A. | X與M形成的化合物中含有離子鍵 | |
| B. | Z、M、Q三種元素的簡單離子的半徑:M>Z>Q | |
| C. | Y與R形成的化合物中R呈正價,說明Y的非金屬性比R強 | |
| D. | 在元素周期表中,Q位于金屬與非金屬的交界處,可以作半導體材料 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com