
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
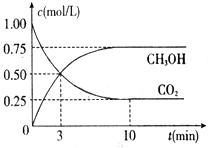
 向恒容密閉容器中充入2.0mol A和3.0mol B,發生反應xA(g)+2B(g)?yC(g).恒溫下反應10min后突然改變某一條件,12min時達到化學平衡狀態I;18min時升高溫度,22min時達到化學平衡狀態II.容器中A、C的物質的量濃度隨時間變化的曲線如圖所示,請根據題給信息回答下列問題:
向恒容密閉容器中充入2.0mol A和3.0mol B,發生反應xA(g)+2B(g)?yC(g).恒溫下反應10min后突然改變某一條件,12min時達到化學平衡狀態I;18min時升高溫度,22min時達到化學平衡狀態II.容器中A、C的物質的量濃度隨時間變化的曲線如圖所示,請根據題給信息回答下列問題:查看答案和解析>>
科目: 來源: 題型:解答題
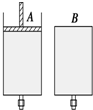 如圖所示,有兩只密閉容器A和B,A容器有一個移動的活塞能使容器內保持恒壓,B容器能保持恒容.起始時向這兩只容器中分別充入等量的體積比為2:1的SO2與O2的混合氣體,并使A和B容積相等(如圖).在保持400℃的條件下使之發生如下反應:2SO2(g)+O2(g)$?_{△}^{催化劑}$2SO3(g),填寫下列空格.
如圖所示,有兩只密閉容器A和B,A容器有一個移動的活塞能使容器內保持恒壓,B容器能保持恒容.起始時向這兩只容器中分別充入等量的體積比為2:1的SO2與O2的混合氣體,并使A和B容積相等(如圖).在保持400℃的條件下使之發生如下反應:2SO2(g)+O2(g)$?_{△}^{催化劑}$2SO3(g),填寫下列空格.查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
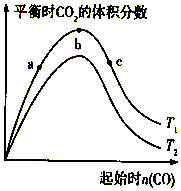 燃煤脫硫可減少SO2尾氣的排放,燃煤脫硫技術受到各界科研人員的關注.一種燃煤脫硫技術的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他條件不變,不同溫度下起始CO物質的量與平衡時體系中CO2的體積分數的關系如圖所示(T表示溫度):下列有關說法正確的是( )
燃煤脫硫可減少SO2尾氣的排放,燃煤脫硫技術受到各界科研人員的關注.一種燃煤脫硫技術的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他條件不變,不同溫度下起始CO物質的量與平衡時體系中CO2的體積分數的關系如圖所示(T表示溫度):下列有關說法正確的是( )| A. | T1比T2高 | |
| B. | b點SO2轉化率最高 | |
| C. | b點后曲線下降是因CO體積分數升高 | |
| D. | 減小壓強可提高CO、SO2轉化率 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 28 g氮氣含有的原子數為NA | |
| B. | 標準狀況下,22.4 L水中含有的水分子數為NA | |
| C. | 1 molOH-含有的電子數為10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+個數為NA |
查看答案和解析>>
科目: 來源: 題型:選擇題
| W | X | Y | Z |
| 單質是淡黃色固體 | 與W同周期,其單質常用作半導體材料 | 原子最外層電子數是電子總數的$\frac{2}{3}$ | 第三周期原子半徑最小的金屬元素 |
| A. | 氣態氫化物的熱穩定性:X>W | |
| B. | 最高價氧化物對應水化物的酸性:Y>X | |
| C. | 簡單離子半徑:Z>W | |
| D. | 工業上用Y單質還原Z的氧化物得Z的單質 |
查看答案和解析>>
科目: 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com