
分析 (1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1,
根據蓋斯定律①-②可得C(s)+H2O(g)=H2(g)+CO(g),據此計算;
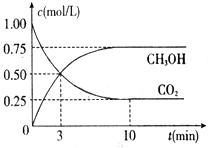
(2)①由圖知反應在10min達到平衡,反應二氧化碳0.75mol,根據熱化學方程式計算此時放出的熱量;
②由二氧化碳的轉化量計算氫氣的轉化量,根據v=$\frac{△c}{△t}$計算速率;
③根據化學平衡時正逆反應速率相等,各組分含量保持不變分析各選項;
④根據化學平衡常數為生成物濃度冪之積與反應物濃度冪之積之比計算K;
⑤往平衡體系中再加入1mol CO2、3mol H2,達到的新平衡相當于對兩個相同的原平衡壓縮體積達到的新平衡狀態,根據壓強對化學平衡的影響可得.
解答 解:(1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0kJ•mol-1;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1.
根據蓋斯定律①-②可得C(s)+H2O(g)=H2(g)+CO(g)△H=+131 kJ•mol-1;
故答案為:C(s)+H2O(g)=H2(g)+CO(g)△H=+131 kJ•mol-1;
(2)①由圖知反應在10min達到平衡,二氧化碳為0.25mol,則反應二氧化碳為:1mol-0.25mol=0.75mol,從題可知1mol二氧化碳充分反應放熱50kJ的熱量,則0.75mol二氧化碳反應放出的熱量為:0.75×50=37.5KJ;
故答案為:37.5kJ;
②前10min內,反應二氧化碳0.75mol,根據化學方程式,反應氫氣為:0.75mol×3=2.25mol,則用氫氣表示的反應速率為:$\frac{2.25mol÷1L}{10min}$=0.225mol•L-1•min-1;
故答案為:0.225;
③A.反應氣體體積前后改變,恒容體系壓強改變,平衡時,容器壓強不變,故正確;
B.平衡時,混合氣體中c(CO2)不變,故正確;
C.vCH3OH)=vH2O,為說明正逆反應速率,故錯誤;
D.c(CH3OH)=c(H2O),不能說明反應達到平衡,故錯誤;
E.混合氣體的總質量不變,恒容混合氣體體積不變,則混合氣體的密度始終不變,故錯誤;
F.混合氣體的總質量不變,混合氣體總物質的量減小,混合氣體的平均相對分子質量變大,平衡時,很合氣體的平均相對分子質量不變,故正確;
故答案為:ABF;
④反應:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)的化學平衡常數表達式為:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
故答案為:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
⑤再加入1mol CO2、3mol H2,達到的新狀態可看做是兩個原來的平衡壓縮體積達到的平衡狀態,若平衡不移動,CO2的物質的量濃度為原來的兩倍,H2的轉化率不變,但該反應是個氣體體積減小的反應,增大壓強,化學平衡正向移動,則CO2的物質的量濃度比原來大,但是比原來兩倍小,H2的轉化率增大;
故答案為:增大;增大.
點評 本題主要考查了化學反應速率的計算,化學平衡的特征,平衡常數的表達式書寫、影響化學平衡的因素等知識點,中等難度,解題要注意基礎知識的運用.


 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案 優秀生應用題卡口算天天練系列答案
優秀生應用題卡口算天天練系列答案 浙江之星課時優化作業系列答案
浙江之星課時優化作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鈉在氯氣中燃燒制氯化鈉 | |
| B. | 二氧化錳和濃鹽酸共熱制氯氣 | |
| C. | 氯氣與消石灰反應制漂白粉 | |
| D. | 氫氣、氯氣混合光照后的產生溶于水制鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③ | B. | ①③⑥ | C. | ③⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| W | X | Y | Z |
| 單質是淡黃色固體 | 與W同周期,其單質常用作半導體材料 | 原子最外層電子數是電子總數的$\frac{2}{3}$ | 第三周期原子半徑最小的金屬元素 |
| A. | 氣態氫化物的熱穩定性:X>W | |
| B. | 最高價氧化物對應水化物的酸性:Y>X | |
| C. | 簡單離子半徑:Z>W | |
| D. | 工業上用Y單質還原Z的氧化物得Z的單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用稀AgNO3溶液洗滌AgCl沉淀比用水洗滌損耗AgCl小 | |
| B. | 對于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者為溶解平衡,后者為電離平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,將AgNO3溶液與NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 將KI溶液加入到AgCl的飽和溶液中,產生黃色沉淀,說明AgCl溶解度大于AgI |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
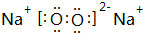 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗 序號 | 實驗內容 | 實驗結果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加熱 | 收集到氣體1.12L(已折算成標準狀況下的體積) |
| 3 | 加足量BaCl2溶液時,對所得沉淀進行洗滌、干燥、稱量;再向沉淀中加足量稀鹽酸,然后干燥、稱量 | 第一次稱量讀數為6.63g,第二次稱量讀數為4.66g |
| 陰離子符號 | 物質的量濃度(mol/L) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com