
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:選擇題
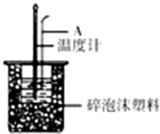 分別取40mL的0.50mol/L鹽酸與40mL0.55mol/L氫氧化鈉溶液進行中和熱的測定.下列說法錯誤的是( )
分別取40mL的0.50mol/L鹽酸與40mL0.55mol/L氫氧化鈉溶液進行中和熱的測定.下列說法錯誤的是( )| A. | 稍過量的氫氧化鈉是確保鹽酸完全反應 | |
| B. | 儀器A的名稱是環形玻璃攪拌棒 | |
| C. | 在實驗過程中,把溫度計上的酸用水沖洗干凈后再測量NaOH溶液的溫度 | |
| D. | 用Ba(OH)2和硫酸代替鹽酸和氫氧化鈉溶液,結果也是正確的 |
查看答案和解析>>
科目: 來源: 題型:多選題
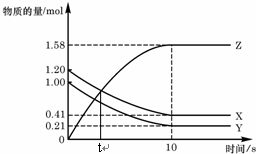 一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖,下列描述正確的是( )
一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖,下列描述正確的是( )| A. | t秒時該反應達到化學平衡狀態 | |
| B. | 反應開始到10 s,X的物質的量濃度減少了0.79mol/L | |
| C. | 反應開始到10s時,Y的轉化率為79.0% | |
| D. | 反應的化學方程式為:X(g)+Y(g)?2Z(g) |
查看答案和解析>>
科目: 來源: 題型:選擇題
| 溫度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 反應初始至平衡,A的平均反應速率v(A)=0.005 mol•L-1•s-1 | |
| B. | 增大壓強,正、逆反應速率均加快 | |
| C. | 該反應正向為吸熱反應,升高溫度,K值增大,平衡正向移動 | |
| D. | 達到平衡后,B的轉化率為50% |
查看答案和解析>>
科目: 來源: 題型:解答題
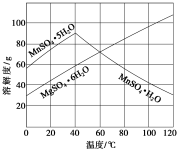 軟錳礦(主要成分MnO2,雜質金屬元素Fe、Al、Mg等)的水懸濁液與煙氣中SO2反應可制備MnSO4•H2O,反應的化學方程式為:MnO2+SO2═MnSO4.
軟錳礦(主要成分MnO2,雜質金屬元素Fe、Al、Mg等)的水懸濁液與煙氣中SO2反應可制備MnSO4•H2O,反應的化學方程式為:MnO2+SO2═MnSO4.查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題
| 溫度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶體 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
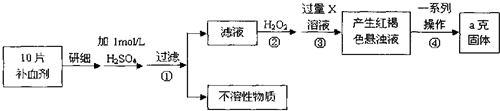
查看答案和解析>>
科目: 來源: 題型:實驗題
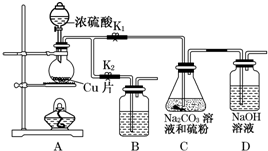
| 編號 | 1 | 2 | 3 | 4 |
| 溶液的體積/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2標準溶液的體積/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | A和B的轉化率均是20% | B. | x=4 | ||
| C. | 平衡時A的物質的量為3.2mol | D. | 平衡時氣體壓強比原來減小 |
查看答案和解析>>
科目: 來源: 題型:多選題
| A. | 用物質 A 表示的反應的平均速率為 0.3 mol•L-1•s-1 | |
| B. | 用物質 B 表示的反應的平均速率為 0.6 mol•L-1•s-1 | |
| C. | 2 s 時物質 A 的轉化率為70% | |
| D. | 2 s 時物質 B 的濃度為 0.7 mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com