
| 溫度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶體 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
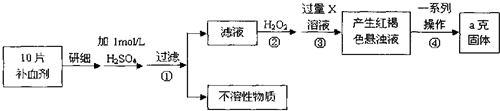
分析 (1)a.將5% Na2CO3溶液加入到盛有一定量廢鐵屑的燒杯中,加熱數分鐘,用傾析法除去Na2CO3溶液,然后將廢鐵屑用水洗滌2~3遍;
b.向洗滌過的廢鐵屑中加入過量的稀硫酸,控制溫度在50~80℃之間至鐵屑耗盡;
c.趁熱過濾,將濾液轉入到密閉容器中,靜置、冷卻結晶;
d.待結晶完畢后,濾出晶體,用少量冰水洗滌2~3次,再用濾紙將晶體吸干;
e.將制得的FeSO4•7H2O晶體放在一個小廣口瓶中,密閉保存
①鐵屑耗盡,不能防止亞鐵離子被氧化;
②溫度低,晶體的溶解度小;
(2)結合圖表中溶解度隨溫度的變化繪制變化曲線圖;
(3)依據圖表數據分析,析出晶體FeSO4•4H2O的溫度范圍;
(4)由流程圖可知,該實驗原理為:將藥品中的Fe2+形成溶液,將Fe2+氧化為Fe3+,使Fe3+轉化為氫氧化鐵沉淀,再轉化為氧化鐵,通過測定氧化鐵的質量,計算補血劑中鐵元素的含量.
①Fe3+遇KSCN溶液顯血紅色,該現象用于檢驗Fe3+存在,可以加入氧化劑將Fe2+氧化為Fe3+.檢驗Fe2+可以先滴加KSCN溶液,溶液不變色,再滴加氯水或雙氧水,溶液變為血紅色,說明含有Fe2+;
②步驟④中一系列處理的操作步驟:過濾、灼燒、稱量;
③若實驗無損耗,則每片補血劑含鐵元素的質量,ag氧化鐵中鐵元素的質量即為10片補血劑中鐵的質量;
④高錳酸鉀溶液氧化亞鐵離子為鐵離子,高錳酸鉀被還原為錳離子,結合原子守恒和電子守恒配平書寫離子方程式;
解答 解:(1)①因亞鐵離子易被氧化,加Fe可防止氧化,所以實驗步驟②明顯不合理,理由是鐵耗盡會使亞鐵離子被氧化為鐵離子,
故答案為:應該鐵屑過量(或反應后溶液中必須有鐵剩余),否則溶液中可能有Fe3+存在;
②晶體表面附著的硫酸等雜質,溫度低,晶體的溶解度小,則少量冰水洗滌,可防止晶體溶解,
故答案為:洗滌除去晶體表面附著的硫酸等雜質;用冰水洗滌可降低洗滌過程中FeSO4•7H2O的損耗;
答案:(1)①應該鐵屑過量(或反應后溶液中必須有鐵剩余),否則溶液中可能有Fe3+存在(2分)
②洗滌除除去晶體表面附著的硫酸等雜質;用冰水洗滌可降低洗滌過程中FeSO4•7H2O的損耗.(2分)
(2)結合圖表中溶解度隨溫度的變化,用描點法繪制變化曲線圖,注意溫度做橫坐標,溶解度做縱坐標,畫出圖象為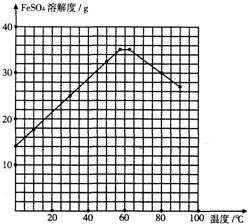 ,
,
故答案為: ;
;
(3)依據圖表數據分析,析出晶體FeSO4•4H2O的溫度范圍應為56.7℃<t<64℃;故答案為:56.7℃<t<64℃;
(4)①Fe3+遇KSCN溶液顯紅色,該現象用于檢驗Fe3+存在,可以加入氧化劑將Fe2+氧化為Fe3+檢驗Fe2+,可以先滴加KSCN溶液,溶液不變色,加入氯水(或雙氧水、稀硝酸),發生2Fe2++Cl2═2Fe3++2Cl-,溶液變為血紅色,發生Fe3++3SCN-?Fe(SCN)3,說明含有Fe2+,
故答案為:氯水(或雙氧水、稀硝酸);溶液由淺綠色變為血紅色;
②步驟④中一系列處理的操作步驟:過濾、灼燒、稱量;
③ag氧化鐵中鐵元素的質量即為10片補血劑中鐵的質量,所以每片補血劑含鐵元素的質量$\frac{\\;ag×\frac{112}{160}}{10}$=0.07ag,故答案為:0.07a;
④高錳酸鉀溶液氧化亞鐵離子為鐵離子,高錳酸鉀被還原為錳離子,結合原子守恒和電子守恒配平書寫化學方程式;10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,
故答案為:10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O;
點評 本題考查了物質制備實驗過程的分析應用,圖象繪制和化學方程式書寫,主要是物質性質和制備性質的理解和實驗基本操作的分析判斷,把握離子性質和分離方法是解題關鍵,題目難度中等.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:解答題
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一種化工原料,常溫下為無色液體,不溶于水,沸點為142.4℃,密度比水小.某實驗小組利用如下裝置合成正丁醚(其它裝置均略去),發生的主要反應為:2C3CH2CH2CH2OH$→_{135°}^{濃H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一種化工原料,常溫下為無色液體,不溶于水,沸點為142.4℃,密度比水小.某實驗小組利用如下裝置合成正丁醚(其它裝置均略去),發生的主要反應為:2C3CH2CH2CH2OH$→_{135°}^{濃H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C5H12 | C7H16 | C8H16 |
| A. | 13 | B. | 14 | C. | 10 | D. | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
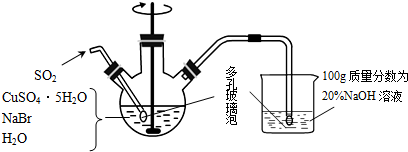
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
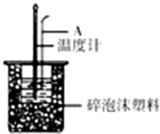 分別取40mL的0.50mol/L鹽酸與40mL0.55mol/L氫氧化鈉溶液進行中和熱的測定.下列說法錯誤的是( )
分別取40mL的0.50mol/L鹽酸與40mL0.55mol/L氫氧化鈉溶液進行中和熱的測定.下列說法錯誤的是( )| A. | 稍過量的氫氧化鈉是確保鹽酸完全反應 | |
| B. | 儀器A的名稱是環形玻璃攪拌棒 | |
| C. | 在實驗過程中,把溫度計上的酸用水沖洗干凈后再測量NaOH溶液的溫度 | |
| D. | 用Ba(OH)2和硫酸代替鹽酸和氫氧化鈉溶液,結果也是正確的 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液在如圖所示的裝置中進行中和反應;通過測定反應過程中所放出的熱量可計算中和反應熱.
50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液在如圖所示的裝置中進行中和反應;通過測定反應過程中所放出的熱量可計算中和反應熱.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴定管未用標準酸液或標準堿液潤洗 | |
| B. | 錐形瓶用待測液潤洗后加入待測液 | |
| C. | 滴定管在滴定前未進行趕氣 | |
| D. | 讀數時視線要平視 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,將四個鉑電極串聯起來通電,則a,b,c,d 四電極上所產生的物質,其物質的量之比為( )
如圖所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,將四個鉑電極串聯起來通電,則a,b,c,d 四電極上所產生的物質,其物質的量之比為( )| A. | 2:2:4:1 | B. | 1:1:2:1 | C. | 2:1:l:1 | D. | 2:2:2:1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com