
科目: 來源: 題型:多選題
| A. | 都是強酸 | B. | 都是弱酸 | ||
| C. | a1 是強酸,a2 是弱酸 | D. | a1 是弱酸,a2 是強酸 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
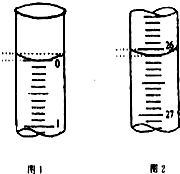 某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液時,選擇甲基橙作指示劑.請填寫下列空白:
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液時,選擇甲基橙作指示劑.請填寫下列空白:| 滴定次數 | 待測氫氧化鈉溶液的體積/mL | 0.1000mol•L-1鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 來源: 題型:選擇題
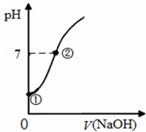 常溫下,向飽和氯水中逐滴滴入0.1mol/L的氫氧化鈉溶液,pH變化如圖所示,下列有關敘述正確的是( )
常溫下,向飽和氯水中逐滴滴入0.1mol/L的氫氧化鈉溶液,pH變化如圖所示,下列有關敘述正確的是( )| A. | ①點所示溶液中只存在次氯酸的電離平衡 | |
| B. | ②點所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的電離程度逐漸減小 |
查看答案和解析>>
科目: 來源: 題型:解答題
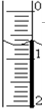 某學生用NaOH標準溶液滴定未知濃度的鹽酸,進項了如下實驗:
某學生用NaOH標準溶液滴定未知濃度的鹽酸,進項了如下實驗:| 實驗次數 | 待測鹽酸體積(mL) | 標準氫氧化鈉溶液體積(mL) | ||
| 初讀數 | 末讀數 | 消耗體積 | ||
| 1 | 15.00 | 0.50 | 17.75 | 17.25 |
| 2 | 15.00 | 0.05 | 16.10 | 16.05 |
| 3 | 15.00 | 0.00 | 15.95 | 15.95 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 應稱取Na2CO3的質量 26.5(g) | 應選用容量瓶的規格 250mL(mL) | 除容量瓶外還需要的其它玻璃儀器是上圖中的燒杯、膠頭滴管及玻璃棒 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 滴定次數 | 待測液體積 (mL) | 標準KMnO4溶液體積(mL) | |
| 滴定前讀數 | 滴定后讀數 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 難溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 顏色 | 白 | 淺黃 | 白 | 磚紅 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目: 來源: 題型:選擇題
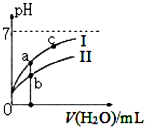 己知:下表為25℃時某些弱酸的電離平衡常數.
己知:下表為25℃時某些弱酸的電離平衡常數.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 圖中c(H+):c(R-)的值:a點>c點(HR代表CH3COOH或HCIO) | |
| B. | pH相同的四種溶液濃度關系:c(CH3COONa>c(NaHC03>c(NaClO>c(Na2C03) | |
| C. | 圖中a點酸的總濃度小于b點酸的總濃度 | |
| D. | 濃度均為0.l mol/L的CH3COONa和NaCIO的混合溶液中:c(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH) |
查看答案和解析>>
科目: 來源: 題型:解答題
| (1)實驗步驟 | 有關問題 |
| ①計算所需Na2SO4的質量 | 需要稱量Na2SO4的質量為2.8g |
| ②稱量Na2SO4固體 | 稱量需要用到的主要儀器是:托盤天平 |
| ③將Na2SO4加入100mL燒杯中,并加入適量水 | 用玻璃棒攪拌至完全溶解,冷卻至室溫 |
| ④將燒杯中溶液轉移至儀器A中(已檢查不漏水) | 儀器A是100mL容量瓶; |
| ⑤洗滌燒杯,轉移,定容 | |
| ⑥搖勻、裝瓶、貼上標簽 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com