
| A. | pH=1的溶液中:Na+、Cl-、K+、HS- | |
| B. | 水電離出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的水溶液中:CH3COO-、CO32-、Na+、K+ | |
| D. | c(Al3+)=1mol/L的溶液中:Na+、NO3-、SO42-、HCO3- |
分析 A.pH=1的溶液中含有大量氫離子,硫氫根離子與氫離子反應;
B.水電離出的c(H+)=10-12mol/L溶液中存在大量氫離子或氫氧根離子,碳酸根離子與氫離子反應,鋇離子與碳酸根離子反應生成碳酸鋇沉淀;
C.該溶液中存在大量氫氧根離子,四種離子之間不反應,都不與氫氧根離子反應;
D.碳酸氫根離子與鋁離子之間發生雙水解反應生成氫氧化鋁沉淀和二氧化碳氣體.
解答 解:A.pH=1的溶液中含有大量氫離子,HS-與氫離子反應生成硫化氫,在溶液中不能大量共存,故A錯誤;
B.水電離出的c(H+)=10-12mol/L溶液為酸性或堿性溶液,溶液中存在大量氫離子或氫氧根離子,CO32-與氫離子反應,Ba2+、CO32-離子反應生成碳酸鋇沉淀,在溶液中不能大量共存,故B錯誤;
C.該溶液中存在大量氫氧根離子,CH3COO-、CO32-、Na+、K+離子之間不反應,且都不與氫氧根離子反應,在溶液中能夠大量共存,故C正確;
D.Al3+、HCO3-之間發生雙水解反應生成氫氧化鋁沉淀和二氧化碳氣體,在溶液中不能大量共存,故D錯誤;
故選C.
點評 本題考查離子共存的判斷,為中等難度的試題,注意明確離子不能大量共存的一般情況,如:能發生復分解反應的離子之間,能發生氧化還原反應的離子之間等;還應該注意題目所隱含的條件,如:溶液的酸堿性,據此來判斷溶液中是否有大量的 H+或OH-;溶液的具體反應條件,如“氧化還原反應”、“加入鋁粉產生氫氣”;是“可能”共存,還是“一定”共存等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
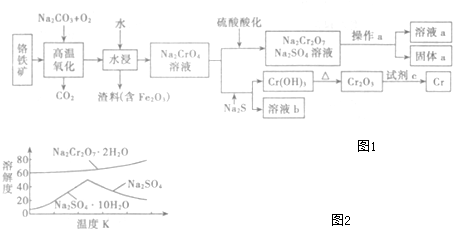
 硫-碘循環分解水制氫主要涉及下列反應:
硫-碘循環分解水制氫主要涉及下列反應:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 目前發現的所有元素占據了周期表里全部位置,不可能再有新的元素被發現 | |
| B. | 元素的性質隨著原子序數的增加而呈周期性變化 | |
| C. | 俄國化學家道爾頓為元素周期表的建立作出了巨大貢獻 | |
| D. | 目前已知發現的第ⅥA族元素為5種,所以該族元素共有5種單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
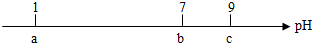
| A. | 常溫下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 當pH=7時,所加NH3•H2O溶液的體積大于10mL | |
| C. | 當7<pH<9時,溶液中c(NH4+)>c(Cl-) | |
| D. | 繼續滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最終可以變化至13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性強弱:HIO4>HBrO4>HClO4 | B. | 原子半徑大小:Na>Mg>Al | ||
| C. | 堿性強弱:KOH>NaOH>LiOH | D. | 金屬性強弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水玻璃可用于制備硅膠和木材防火劑 | |
| B. | 在現代化學工業中催化劑的應用十分普遍,對于給定條件下反應物之間能夠同時發生多個反應時,理想催化劑還可以大幅度提高目標產物在最終產物中的比率 | |
| C. | 煤經過氣化和液化兩個物理變化過程,可變為清潔能源 | |
| D. | PM2.5是指大氣中直徑小于或等于2.5微米的顆粒物,也稱為“細顆粒物”,PM2.5分散在空氣中可能形成膠體或濁液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
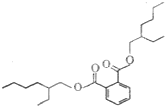 塑化劑是工業上被廣泛使用的高分子材料添加劑,食用后對人體有害,其結構式如圖.下列有關塑化劑的說法正確的是( )
塑化劑是工業上被廣泛使用的高分子材料添加劑,食用后對人體有害,其結構式如圖.下列有關塑化劑的說法正確的是( )| A. | 易溶于水,其水溶液有丁達爾效應 | B. | 在稀硫酸中不能穩定存在 | ||
| C. | 不能發生還原反應 | D. | 不能發生氧化反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com