

分析 (1)①采用過量的O2,可以提高二氧化硫轉化率;達平衡時各組分的濃度保持不變;
②平衡常數等于生成物濃度冪之積比上反應濃度冪之積,即K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
③已知:K(300℃)>K(450℃),升高溫度平衡常數減小,說明平衡逆向移動,而升高溫度平衡向吸熱反應方向移動;
(2)平衡常數只受溫度影響,溫度不變,平衡常數不變;
(3)①甲為恒溫恒容容器,若移動活塞P,使乙的容積和甲相等,為恒溫恒容容器,乙中加入4mol三氧化硫相當于加入2mol三氧化硫,再加入2mol三氧化硫,增大壓強,平衡正向進行,SO3的體積分數增大;
②甲為恒溫恒容容器,加入氦氣總壓增大,分壓不變,平衡不變,乙中加入氦氣為保持恒壓,體積增大,壓強減小,平衡逆向進行,達到新平衡時,SO3的體積分數減小.
解答 解:(1)①從平衡角度分析采用過量O2的目的是,利用廉價原料提高物質轉化率,加入氧氣提高二氧化硫的轉化率,
a.SO2和SO3 濃度不變,不一定相等,故錯誤;
b.SO2 百分含量保持不變,說明反應達平衡狀態,故正確;
c.容器中氣體的壓強不變,說明氣體的物質的量不變反應達平衡狀態,故正確;
d.只要反應發生就符合,SO3的生成速率與SO2的消耗速率相等,故錯誤;
故答案為:提高二氧化硫的轉化率; bc;
②平衡常數等于生成物濃度冪之積比上反應濃度冪之積,即K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$,故答案為:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
③K(300℃)>K(450℃),說明溫度越高平衡常數越小,反應逆向進行,升溫平衡向吸熱反應方向進行,正反應為放熱反應,升溫平衡逆向進行,二氧化硫轉化率減小,
故答案為:放;減小;
(2)平衡常數只受溫度影響,與壓強無關,平衡狀態由A變到B時,二者溫度相同,故平衡常數K(A)=K(B),故答案為:=;
(3)將2mol SO2和1mol O2加入甲容器中,將4mol SO3加入乙容器中,隔板K不能移動.此時控制活塞P,使乙的容積為甲的2倍,可知甲、乙中最后達到相同的平衡狀態;
①若移動活塞P,使乙的容積和甲相等,增大壓強,平衡正向進行,SO3的體積分數增大,SO3的體積分數甲<乙,
故答案為:<;
②甲為恒溫恒容容器,加入氦氣總壓增大,分壓不變,平衡不變,乙中加入氦氣,為保持恒壓,體積增大,壓強減小,平衡逆向進行,達到新平衡時,SO3的體積分數減小,SO3的體積分數甲大于乙,
故答案為:>.
點評 本題考查化學平衡常數、化學平衡計算與影響因素,題目難度中等,注意平衡常數在計算中的應用,(3)中關鍵是構建等效平衡建立途徑.


 名校提分一卷通系列答案
名校提分一卷通系列答案 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案 新卷王期末沖刺100分系列答案
新卷王期末沖刺100分系列答案 全能闖關100分系列答案
全能闖關100分系列答案科目:高中化學 來源: 題型:選擇題
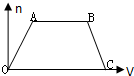 將足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物質的量(n)和通入CO2氣體的體積(V)的關系如圖所示,圖中AB段表示的離子方程式先后順序正確的是( )
將足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物質的量(n)和通入CO2氣體的體積(V)的關系如圖所示,圖中AB段表示的離子方程式先后順序正確的是( )| A. | ③① | B. | ②⑤ | C. | ⑤④ | D. | ④② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO32-離子是弱酸根,開始階段與H+結合,生成HCO3- | |
| B. | 溶液中的Na+、Cl-抑制了CO2生成 | |
| C. | 開始生成的CO2與Na2CO3反應,生成了NaHCO3 | |
| D. | CO32-離子在水中,存在兩個水解平衡,開始階段可能是H+結合OH-,生成HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘單質-分子晶體 | B. | 鋁銅鐵合金-準晶體 | ||
| C. | 石墨-原子晶體 | D. | 氧化鎂-離子晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.25a | B. | 0.35a | C. | 0.45a | D. | 0.50a |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | 雜質 | 試劑 | 提純方法 | |
| A | 苯 | 苯酚 | 溴水 | 分液 |
| B | 二氧化碳 | 二氧化硫 | 飽和碳酸鈉溶液 | 洗氣 |
| C | 甲烷 | 乙烯 | 酸性高錳酸鉀溶液 | 洗氣 |
| D | 甲醛 | 甲酸 | 稀氫氧化鈉溶液 | 蒸餾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 8,18,32,32 | B. | 8,18,18,32 | C. | 8,18,18,18 | D. | 8,8,18,18 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com