
分析 ①依據m=CVM計算需要溶質的質量;
②依據配制溶液體積及容量瓶規格選擇容量瓶;
③為保證溶質全部轉移到容量瓶,應洗滌沾到玻璃棒和燒杯內壁上的溶質;
④依據定容的正確操作解答,凡是操作引起實驗失敗且不能補救的都需要重新配制溶液;
⑤定容搖勻后部分溶液沾到瓶塞上導致液面下降;
⑥分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行判斷.
解答 解:①配制0.100mol/L的Na2CO3溶液400mL,應選擇500mL容量瓶,實際配制500mL溶液,需要溶質的質量m=0.100mol/L×0.5L×106g/mol=5.3g;
故答案為:5.30;
②配制0.100mol/L的Na2CO3溶液400mL,實驗室沒有400mL容量瓶,所以應選擇500mL容量瓶;
故答案為:500;
③為保證溶質全部轉移到容量瓶,應洗滌沾到玻璃棒和燒杯內壁上的溶質;
故答案為:玻璃棒和燒杯內壁;
④繼續向容量瓶中緩緩加入蒸餾水至液面距離刻度線1~2cm處,改用膠頭滴管逐滴滴加蒸餾水至溶液的凹液面正好與刻度線相切.若不慎超出,宣告實驗失敗且無法補救,需要重新配制;
故答案為”膠頭滴管 重新配制;
⑤定容搖勻后部分溶液沾到瓶塞上導致液面下降,屬于正常操作,不需要補充加水;
故答案為:不需要;
⑥(1)容量瓶在使用之前需加少量蒸餾水進行“檢漏”操作,這會造成容量瓶潮濕,定容時仍然需要加入蒸餾水,所以對溶質的物質的量和溶液體積都不會產生影響,溶液濃度不變,故選:C;
(2)有些固體溶解會放熱,若未經冷卻即轉移至容量瓶,冷卻后溶液體積偏小,則所得溶液的濃度會偏高,故選;B;
(3)若未經洗滌或洗滌液在轉移時不慎灑在了實驗桌上,導致部分溶質損耗,溶質的物質的量偏小,則所得溶液的濃度會偏低,故選:A;
故答案為:(1)C (2)B (3)A.
點評 本題考查了一定物質的量濃度溶液的配制,明確配制原理和操作步驟是解題關鍵,注意容量瓶規格的選擇和使用方法,注意誤差分析的方法.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鈉常溫下與氧氣反應生成Na2O,升高溫度生成 Na2O的速率加快 | |
| B. | 常溫下,銅與稀硝酸反應生成NO,增大硝酸的濃度,生成NO的速率加快 | |
| C. | 鋅與稀硫酸制備氫氣,加入少量的硫酸銅溶液,生成H2的速率加快 | |
| D. | 對密閉容器中發生的反應2NO2?2NO+O2 縮小體積,增大壓強,V(正)減小,V(逆)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,5.6L O2作氧化劑時轉移電子數一定為NA | |
| B. | 用惰性電極電解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液復原,則電路中轉移電子的數目為0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑如果有5molH2O參加氧化還原反應,則由水還原的BrF3分子數目為3NA | |
| D. | 142gNa2SO4和Na2HPO4固體混合物中,陰陽離子總數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 應量取濃鹽酸體積/mL | 應選用容量瓶的規格/mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 4種相鄰主族短周期元素的相對位置如表,元素X的核外電子數是元素M的2倍,Y的氧化物具有兩性,回答下列問題.
4種相鄰主族短周期元素的相對位置如表,元素X的核外電子數是元素M的2倍,Y的氧化物具有兩性,回答下列問題. ,氣體分子(MN)2的電子式:
,氣體分子(MN)2的電子式: ,X形成的離子的電子式:Mg2+.
,X形成的離子的電子式:Mg2+.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
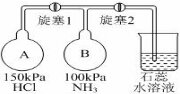
 ClO2與Cl2的氧化性相近,在自來水消毒和果蔬保鮮等方面應用廣泛.某興趣小組通過圖1裝置(夾持裝置略)對其制備、吸收、釋放和應用進行了研究.
ClO2與Cl2的氧化性相近,在自來水消毒和果蔬保鮮等方面應用廣泛.某興趣小組通過圖1裝置(夾持裝置略)對其制備、吸收、釋放和應用進行了研究.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
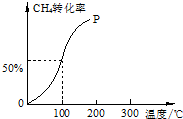 以CH4和H2O為原料,通過下列反應來制備甲醇.
以CH4和H2O為原料,通過下列反應來制備甲醇.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com