
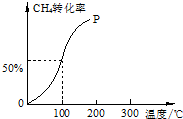
 以CH4和H2O為原料,通過下列反應來制備甲醇.
以CH4和H2O為原料,通過下列反應來制備甲醇.分析 (1)已知I:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
II:CO(g)+2H2(g)?CH3OH(g)△H=-129.0kJ•mol-1
根據蓋斯定律,Ⅰ+Ⅱ可得:CH4(g)+H2O(g)?CH3OH(g)+H2(g);
(2)100℃時達到平衡時,甲烷轉化率為50%,結合化學平衡三段式列式計算平衡時各組分的物質的量,
①根據c=$\frac{\frac{△n}{V}}{△t}$計算v(H2);
②計算平衡狀態時各物質的濃度,代入平衡常數表達式K=$\frac{c(CO)×{c}^{3}({H}_{3})}{c(C{H}_{4})×c({H}_{2}O)}$;
(3)可逆反應到達平衡時,同種物質的正逆速率相等且保持不變,各組分的濃度、含量保持不變,由此衍生的其它一些量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化說明到達平衡;
(4)其他條件不變,平衡后將容器的容積壓縮到原來的$\frac{1}{2}$,壓強增大,正、逆反應速率都增大,但正反應速率增大更多,平衡向正反應方向移動,生成物的濃度增大,由于溫度不變,則平衡常數不變,結合平衡常數可知,平衡時反應物各組分的濃度都增大,據此分析解答.
解答 解:(1)已知I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
根據蓋斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g) 則△H=+206.0kJ•mol-1-129.0kJ•mol-1=+77kJ•mol-1,
故答案為:+77;
(2)將1.0mol CH4和2.0mol H2O ( g )通入容積固定為100L的反應室,在一定條件下發生反應I,由圖象可知100℃甲烷轉化率為50%,故參加反應的甲烷為1mol×50%=0.5mol,則:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
變化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假設100℃時達到平衡所需的時間為5min,則用H2表示該反應的平均反應速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,
故答案為:0.003 mol•L-1•min-1;
②100℃時反應I的平衡濃度為c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常數K=$\frac{c(CO)×{c}^{3}({H}_{3})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案為:2.25×10-4;
(3)A.有2個H-H鍵生成的同時有3個C-H鍵斷裂,均表示逆反應速率,反應始終按該比例關系進行,故A錯誤;
B.可逆反應到達平衡時各組分含量不變,CO百分含量保持不變,說明反應到達平衡,故B正確;
C.隨反應進行混合氣體物質的量減小,恒溫恒容下壓強減小,容器中混合氣體的壓強保持不變,說明反應到達平衡,故C正確;
D.混合氣體總質量不變,容器容積不變,容器中混合氣體的密度為定值,故D錯誤,
故選:BC;
(4)A.平衡后將容器的容積壓縮到原來的$\frac{1}{2}$,壓強增大,平衡向正反應方向移動,生成物的濃度增大,由于平衡常數不變,結合平衡常數可知,平衡時反應物各組分的濃度都增大,故A錯誤;
B.壓強增大,正、逆反應速率都增大,但正反應速率增大更多,故B錯誤;
C.壓強增大,平衡向正反應方向移動,CH3OH 的物質的量增加,故C正確;
D.壓強增大,平衡向正反應方向移動,氫氣的物質的量減小、甲醇的物質的量增大,故重新平衡$\frac{{c({H_2})}}{{c(C{H_3}OH)}}$減小,故D正確;
E.平衡常數只受溫度影響,溫度不變,平衡常數不變,故E錯誤,
故答案為:CD.
點評 本題考查化學平衡計算與影響因素、化學平衡狀態判斷、化學平衡圖象、平衡常數與反應速率計算、蓋斯定律應用等,注意判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化說明到達平衡,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
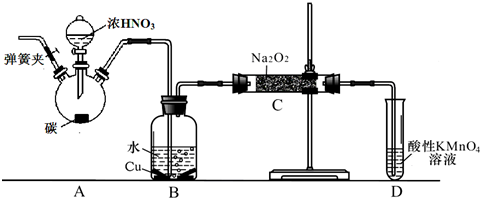
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
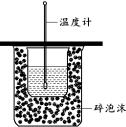 下列實驗操作正確的是( )
下列實驗操作正確的是( )| A. | 用圖裝置測定中和熱 | |
| B. | 將同濃度的FeCl3溶液和CuSO4溶液分別滴入H2O2中,滴入FeCl3溶液的H2O2更快產生氣泡.不能得出結論對H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+濃度對該平衡:Cr2O72-+H2?2CrO42-+2H+的影響,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 測定溶液的pH值時,用玻璃棒蘸取少量溶液點在濕潤的pH試紙上再與標準比色卡對照 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,1L的密閉容器中恰好可盛放n個N2分子和m個H2分子組成的混合氣體,則阿伏伽德羅常數NA可近似表示為$\frac{m+n}{22.4}$mol-1 | |
| B. | 標準狀況下,32g O3和O2的混合氣體中,含有氧原子數一定為2NA | |
| C. | 等體積、等濃度的磷酸溶液和鹽酸溶液,其溶液中含有的氫元素質量之比一定為3:1 | |
| D. | 等物質的量的干冰和葡萄糖(C6H12O6)中所含碳原子數之比一定為2:6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體的分散質能透過濾紙 | |
| B. | 膠體能產生丁達爾現象 | |
| C. | 膠體粒子直徑在10-9~10-7 m之間 | |
| D. | 膠體是純凈物,其它分散系是混合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
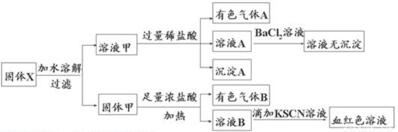
| A. | 溶液甲中一定含有K2SO3、NaNO2 | B. | 無法判斷溶液中是否有K2SO3 | ||
| C. | 氣體A和氣體B-定為混合物 | D. | 原混合物中一定有Fe2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L的NaOH溶液與0.1 mol/L的CH3COOH溶液等體積混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常溫下,0.01 mol/L的NaOH溶液與pH=2的CH3COOH溶液等體積混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常溫下,0.1 mol/L的CH3COOH溶液與0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等體積混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com