
 氨氣是一種重要的化工原料,大量用于制造尿素、純堿、銨態氮肥以及硝酸,在有機合成工業中制合成纖維、塑料、染料等.請回答下列問題:
氨氣是一種重要的化工原料,大量用于制造尿素、純堿、銨態氮肥以及硝酸,在有機合成工業中制合成纖維、塑料、染料等.請回答下列問題:| 容器編號 | 起始時各物質物質的量/mol | 平衡時反應 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比較 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
分析 (1)由于所給的①和②中存在氫氣的燃燒,缺少氫氣燃燒的數據;
(2)a和b比較是反應物的濃度增加一倍,據此可以計算b放出的能量E,由于溫度不變,可以計算b狀態的平衡常數;
(3)反應物濃度越大,反應速率越大;t1時刻后,化學反應達到平衡,據此判斷;溫度升高,化學反應速率加快,達到平衡時間變短,且平衡左移,導致氨氣的物質的量減小,據此解答即可;
(4)平衡狀態的標志是:正逆反應速率相等,根據平衡常數表達式來計算平衡常數;根據任意態的濃度熵和平衡常數的關系來判斷是否是平衡狀態以及反應的移動方向.
解答 解:(1)由于沒有給出氫氣的燃燒熱數據,故不能利用①和②表示△H,故答案為:無;不能,缺少氫氣的燃燒熱;
(2)b與a相比,是反應物的濃度增大一倍,
①由于b是增加的反應物的濃度,導致平衡右移,故反應a和反應b的氫氣轉化率不相同,故①錯誤;
②溫度不變,平衡常數不變,可以依據數據23.1計算此時的平衡常數,b狀態下平衡常數與a相等,故②正確;
③b中濃度是a的2倍,利用已知數據可以計算反應b放出的能量E,故③正確;
④由于b狀態與a相比,濃度增大,平衡右移,故氨氣體積不同,故④錯誤,
故選②③;
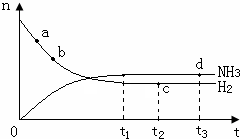
(3)由于a點反應物的物質的量最大,故a點化學反應速率最快,時刻,化學反應達到平衡狀態,此時各種物質的物質的量不變,即c、d兩點氮氣的物質的量相同,溫度升高,化學反應速率加快,達到平衡時間變短,且平衡左移,導致氨氣的物質的量減小,此時圖象為: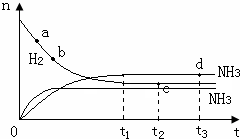 ,故答案為:a;cd;
,故答案為:a;cd;  ;
;
(4)設備I中正逆反應速率相等的狀態是平衡狀態,根據平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}{(C{O}_{2})×c}^{6}({H}_{2})}$=$\frac{(1×1{0}^{-4})^{4}}{(1×1{0}^{-2})^{8}}$=1,因為該反應的平衡常數K=1.0,而設備 II中Qc=c(CH3OCH3)•c3(H2O)/c2(CO2)•c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反應正在向逆反應方向進行,v(正)<v(逆),故答案為:因為該反應的平衡常數K=1.0,而設備 II中Qc=c(CH3OCH3)•c3(H2O)/c2(CO2)•c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反應正在向逆反應方向進行,v(正)<v(逆),
故答案為:是;1.0;v(正)<v(逆).
點評 本題主要考查的是蓋斯定律的應用、化學反應速率與平衡以及其影響因素、平衡常數的計算等,本題綜合性較強,難度較大.


 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:高中化學 來源: 題型:多選題
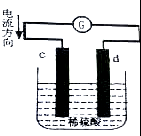 如圖是鋅片和銅片同時插入稀硫酸中所組成的原電池裝置,c,d為兩個電極.則下列有關的判斷不正確的是( )
如圖是鋅片和銅片同時插入稀硫酸中所組成的原電池裝置,c,d為兩個電極.則下列有關的判斷不正確的是( )| A. | d為負極,電池工作時,d極發生氧化反應 | |
| B. | c為鋅片,電池工作時,溶液中SO42-向c極移動 | |
| C. | 電池工作的過程中,d電極上產生大量的氣泡 | |
| D. | 電池工作的過程中,溶液的pH基本不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②①③④⑤ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③②①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
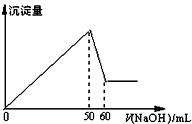 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如圖所示,則原混合液中AlCl3與MgCl2的物質的量濃度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如圖所示,則原混合液中AlCl3與MgCl2的物質的量濃度| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| a | 原子核外電子分別占3個不同能級,且每個能級上排布的電子數相同 |
| b | 基態原子的p軌道電子數比s軌道電子數少1 |
| c | 在周期表所列元素中電負性最大 |
| d | 基態原子M層全充滿,N層只有一個電子 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 事實 | 非金屬性強弱 | |
| A | CH4受熱分解的溫度比SiH4高 | C>Si |
| B | C與SiO2在高溫下反應生成Si和CO | C>Si |
| C | 稀鹽酸與Na2SiO3溶液反應生成H2SiO3膠體 | Cl>Si |
| D | H2SO3是中強酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com