
| 事實 | 非金屬性強弱 | |
| A | CH4受熱分解的溫度比SiH4高 | C>Si |
| B | C與SiO2在高溫下反應生成Si和CO | C>Si |
| C | 稀鹽酸與Na2SiO3溶液反應生成H2SiO3膠體 | Cl>Si |
| D | H2SO3是中強酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A、氫化物穩定,中心元素的非金屬性越強;
B、在高溫條件下,C能置換出SiO2中的Si,C表現出金屬;
C、稀鹽酸與Na2SiO3溶液反應生成H2SiO3膠體,說明鹽酸的酸性強于硅酸,而鹽酸不是含氧酸,所以無法比較氯與硅的非金屬性強弱;
D、H2SO3不是最高價含氧酸,所以無法比較硫與硅的非金屬性強弱.
解答 解:A、氫化物穩定,中心元素的非金屬性越強,因為CH4受熱分解的溫度比SiH4高,所以非金屬性:C>Si,故A正確;
B、在高溫條件下,C能置換出SiO2中的Si,C表現出金屬性,不能用該反應比較非金屬性強弱,故B錯誤;
C、稀鹽酸與Na2SiO3溶液反應生成H2SiO3膠體,說明鹽酸的酸性強于硅酸,而鹽酸不是含氧酸,所以無法比較氯與硅的非金屬性強弱,故C錯誤;
D、H2SO3不是最高價含氧酸,所以無法比較硫與硅的非金屬性強弱,故D錯誤;
故選A.
點評 本題考查非金屬元素在周期表中的位置及性質遞變規律和酸性比較等知識,側重于學生的分析能力和實驗能力的考查,為高考常見題型,注意相關知識的學習與積累,難度不大.


科目:高中化學 來源: 題型:填空題
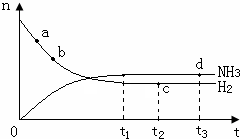 氨氣是一種重要的化工原料,大量用于制造尿素、純堿、銨態氮肥以及硝酸,在有機合成工業中制合成纖維、塑料、染料等.請回答下列問題:
氨氣是一種重要的化工原料,大量用于制造尿素、純堿、銨態氮肥以及硝酸,在有機合成工業中制合成纖維、塑料、染料等.請回答下列問題:| 容器編號 | 起始時各物質物質的量/mol | 平衡時反應 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比較 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
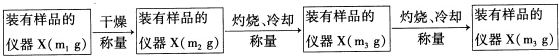
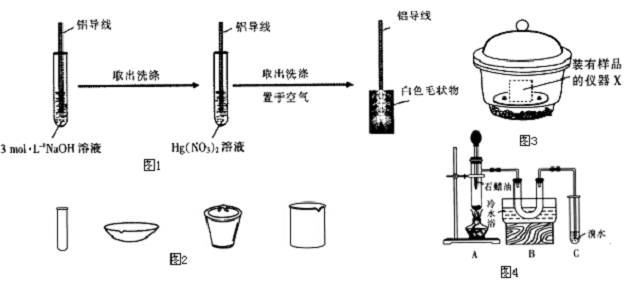
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不銹鋼是一種純凈物,它比純鐵的硬度大 | |
| B. | 鋁合金是用量最大、用途最廣的合金 | |
| C. | 青銅、硬鋁和生鐵都屬于合金 | |
| D. | Na-K合金的熔點介于Na和K單質熔點之間 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
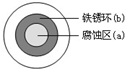
| A. | 液滴中的Cl-由a區向b區遷移 | |
| B. | 液滴邊緣是正極區,發生的電極反應為:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因發生還原反應而被腐蝕,生成的Fe2+由a區向b區遷移,與b區的OH-形成Fe(OH)2,進一步氧化、脫水形成鐵銹 | |
| D. | 若改用嵌有一銅螺絲釘的鐵板,在銅鐵接觸處滴加NaCl溶液,則負極發生的電極反應為:Cu-2e-→Cu2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 陶瓷的主要成分是碳酸鈣 | |
| B. | 用鐵容器存放濃鹽酸 | |
| C. | 硅是制造半導體的常用材料 | |
| D. | 工業上利用氨氣制硝酸屬于人工固氮 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com