
 二甲醚(CH3OCH3)被稱為21世紀的新型燃料,在未來可能替代汽油、液化氣、煤氣等并具有優良的環保性能.工業制備二甲醚在催化反應室中(壓力2.0~10.0Mpa,溫度230~280℃)進行下列反應:
二甲醚(CH3OCH3)被稱為21世紀的新型燃料,在未來可能替代汽油、液化氣、煤氣等并具有優良的環保性能.工業制備二甲醚在催化反應室中(壓力2.0~10.0Mpa,溫度230~280℃)進行下列反應:分析 (1)已知反應①是體積減小的放熱反應,根據外界條件對平衡的影響分析;
(2)5min后達到平衡,CO的轉化率為50%,則△c(CO)=1mol/L×50%=0.5mol/L,根據v(CO)=$\frac{△c}{△t}$計算v(CO);
計算該溫度下的平衡常數,根據平衡常數計算平衡時氫氣的濃度,根據甲醇的平衡濃度計算氫氣濃度的變化量,進而計算a的值;
(3)根據蓋斯定律由已知的熱化學方程式乘以相應的數值進行加減,來構造目標熱化學方程式,反應熱也乘以相應的數值進行加減;
(4)依據燃燒熱概念含義是1mol甲醚完全燃燒生成穩定氧化物二氧化碳和液態水放出的熱量為燃燒熱,結合書寫方法寫出熱化學方程式;
(5)依據圖示分析通入氧氣的一端為正極,通入二甲醚的一端為負極,電解質溶液為酸性環境,二甲醚失電子生成二氧化碳,根據電子守恒寫出電極反應.
解答 解:(1)已知反應①是體積減小的放熱反應,若要增大反應①中H2的轉化率,則需要使平衡正移,所以改變的條件為加入一定量CO或反應溫度降低;
故答案為:BC;
(2)5min后達到平衡,CO的轉化率為50%,則△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min);
該溫度到達平衡時,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以該溫度下,平衡常數k=$\frac{0.5}{0.5×1.{4}^{2}}$=$\frac{25}{49}$,若反應物的起始濃度分別為:c(CO)=4mol/L,c(H2)=a mol/L,達到平衡后,c(CH3OH)=2mol/L,則平衡時c′(CO)=4mol/L-2mol/L=2mol/L,令平衡時氫氣的濃度為ymol/L,所以$\frac{2}{2×{y}^{2}}$=$\frac{25}{49}$解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L.
故答案為:0.1mol/(L•min);5.4.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol,
由蓋斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
催化反應室中溫度低于830°C,反應是放熱反應,降低溫度平衡正向進行,平衡常數增大,K>1.0,
故答案為:-246.1kJ/mol,>;
(4)甲醚的燃燒熱為1455kJ/mol,則燃燒方式的熱化學方程式為:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案為:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
(5)反應本質是二甲醚的燃燒,原電池負極發生氧化反應,二甲醚在負極放電,正極反應還原反應,氧氣在正極放電.由圖可知,a極為負極,b為正極,二甲醚放電生成二氧化碳與氫離子,a電極的電極反應式為 CH3OCH3-12e-+3H2O═2CO2+12H+;
故答案為:CH3OCH3+3H2O-12e-═2CO2+12H+.
點評 本題考查熱化學方程式書寫,燃燒熱概念,平衡移動,圖象分析應用,原電池電極反應的書寫方法,題目難度中等.


 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 銅和稀硫酸反應:Cu+2H+═Cu2++H2↑ | |
| B. | 氫氧化銅溶于鹽酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸鈣與稀鹽酸反應:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸與氫氧化鋇溶液反應:H++OH-═H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
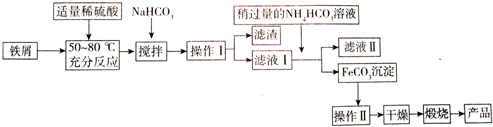
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若某溫度下,反應后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,則溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 參加反應的氯氣的物質的量等于0.5a mol | |
| C. | 改變溫度,反應中轉移電子的物質的量ne的范圍:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改變溫度,產物中KClO3的最大理論產量為$\frac{a}{6}$mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由0.1mol•L-1的CH3COOH溶液與0.1 mol•L-1的NaOH溶液等體積混合而成 | |
| B. | 由10mLpH=3的CH3COOH溶液與1 mL pH=11的NaOH溶液混合而成 | |
| C. | 由0.1mol•L-1的CH3COONa溶液與0.1 mol•L-1的NaOH溶液等體積混合而成 | |
| D. | 由0.1mol•L-1的CH3COONa溶液與0.1 mol•L-1的CH3COOH溶液等體積混合而成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com