
| A. | 銅和稀硫酸反應:Cu+2H+═Cu2++H2↑ | |
| B. | 氫氧化銅溶于鹽酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸鈣與稀鹽酸反應:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸與氫氧化鋇溶液反應:H++OH-═H2O |
 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
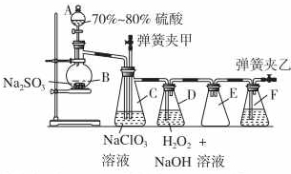 用二氧化氯(ClO2)可制備用途廣泛的亞氯酸鈉(NaClO2),實驗室可用下列裝置(略去部分夾持儀器)制備少量的亞氯酸鈉.
用二氧化氯(ClO2)可制備用途廣泛的亞氯酸鈉(NaClO2),實驗室可用下列裝置(略去部分夾持儀器)制備少量的亞氯酸鈉.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2O3溶于過量的氫酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入過量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2氣體:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀鹽酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)某溫度下,在一密閉容器中,X、Y、Z 三種氣體的物質的量隨時間的變化曲線如圖所示.分析有關數據,寫出X、Y、Z反應的化學方程式X+3Y
(1)某溫度下,在一密閉容器中,X、Y、Z 三種氣體的物質的量隨時間的變化曲線如圖所示.分析有關數據,寫出X、Y、Z反應的化學方程式X+3Y 2Z.
2Z.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 二甲醚(CH3OCH3)被稱為21世紀的新型燃料,在未來可能替代汽油、液化氣、煤氣等并具有優良的環保性能.工業制備二甲醚在催化反應室中(壓力2.0~10.0Mpa,溫度230~280℃)進行下列反應:
二甲醚(CH3OCH3)被稱為21世紀的新型燃料,在未來可能替代汽油、液化氣、煤氣等并具有優良的環保性能.工業制備二甲醚在催化反應室中(壓力2.0~10.0Mpa,溫度230~280℃)進行下列反應:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com