
 (1)某溫度下,在一密閉容器中,X、Y、Z 三種氣體的物質的量隨時間的變化曲線如圖所示.分析有關數據,寫出X、Y、Z反應的化學方程式X+3Y
(1)某溫度下,在一密閉容器中,X、Y、Z 三種氣體的物質的量隨時間的變化曲線如圖所示.分析有關數據,寫出X、Y、Z反應的化學方程式X+3Y 2Z.
2Z.分析 (1)由圖象可知,反應中X、Y的物質的量減少,應為反應物,Z的物質的量增多,應為生成物,當反應進行到2min時,X、Y的物質的量不變且不為0,屬于可逆反應,△n(Y)=0.3mol,△n(X)=0.1mol,△n(Z)=0.2mol,參加反應的物質的物質的量之比等于化學計量數之比;
(2)可逆反應到達平衡時,同種物質的正逆速率相等,各組分的濃度、物質的量、含量保持不變,右側衍生的其它一些物理量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不變化,說明到達平衡;
(3)設消耗的X為nmol,表示出平衡時各組分物質的量,再根據Z的含量列方程計算解答.
解答 解(1)由圖象可知,反應中X、Y的物質的量減少,應為反應物,Z的物質的量增多,應為生成物,當反應進行到2min時,X、Y的物質的量不變且不為0,屬于可逆反應,△n(Y)=0.3mol,△n(X)=0.1mol,△n(Z)=0.2mol,則△n(Y):△n(X):△n(Z)=3:1:2,參加反應的物質的物質的量之比等于化學計量數之比,則反應的方程式為:X+3Y 2Z,
2Z,
故答案為:X+3Y 2Z;
2Z;
(2)A.X、Y的起始物質的量相等,二者按1:3反應,平衡時二者物質的量濃度一定不相等,故A錯誤;
B.溫度和體積一定時,生成物濃度不再變化,說明到達平衡,故B正確;
C.隨反應進行混合氣體總物質的量減小,溫度和體積一定時,隨反應進行壓強減小,若容器內的壓強不再變化,說明到達平衡,故C正確;
D.混合氣體總質量不變,隨反應進行混合氣體總物質的量減小,混合氣體的平均相對分子質量增大,若混合氣體的平均相對分子質量不再變化,說明到達平衡,故D正確,
故選:BCD;
(3)設消耗的X為nmol,則:
X(g)+3Y(g) 2Z(g)
2Z(g)
起始量(mol):2 3 0
變化量(mol):n 3n 2n
平衡量(mol):2-n 3-3n 2n
所以$\frac{2n}{5-2n}$=25%,解得n=0.5,則平衡時X的物質的量濃度為$\frac{(2-0.5)mol}{2L}$=0.75mol/L,
故答案為:0.75mol/L.
點評 本題考查化學平衡計算、平衡狀態判斷等,難度不大,注意判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不變化說明到達平衡.


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:選擇題
 “諾龍”屬于國際奧委會明確規定的違禁藥品中合成代謝類的類固醇,其結構簡式如圖所示.下列關于“諾龍”的說法中錯誤的是( )
“諾龍”屬于國際奧委會明確規定的違禁藥品中合成代謝類的類固醇,其結構簡式如圖所示.下列關于“諾龍”的說法中錯誤的是( )| A. | 分子式是C18H26O2 | |
| B. | 能發生銀鏡反應 | |
| C. | 既能發生加成反應,也能發生酯化反應 | |
| D. | 既能發生氧化反應,也能發生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅和稀硫酸反應:Cu+2H+═Cu2++H2↑ | |
| B. | 氫氧化銅溶于鹽酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸鈣與稀鹽酸反應:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸與氫氧化鋇溶液反應:H++OH-═H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
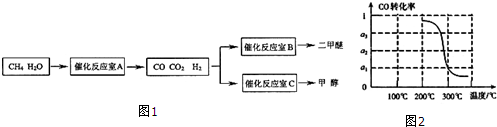
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:填空題
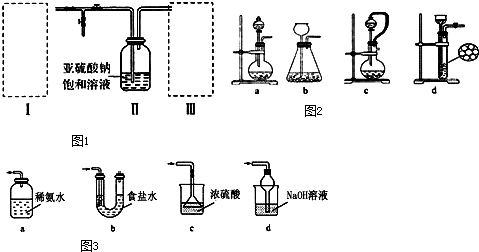
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
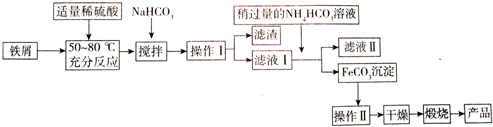
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若某溫度下,反應后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,則溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 參加反應的氯氣的物質的量等于0.5a mol | |
| C. | 改變溫度,反應中轉移電子的物質的量ne的范圍:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改變溫度,產物中KClO3的最大理論產量為$\frac{a}{6}$mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com