
分析 (1)工業中,從合成塔出來的混合氣體成分是NH3、H2、N2;在進入分離器之前,需進入冷卻塔;
(2)根據可逆反應的特點分析解答;
(3)氨氣在工業制備硝酸生產中的作用氨氣與氧氣反應生成一氧化氮和水,反應的化學方程式為:4NH3+O2$\frac{\underline{\;\;\;催化劑\;\;\;}}{高溫高壓}$4NO+6H2O;由反應方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑可知,2mol的尾氣生成1mol的二氧化碳,所以每吸收5mol尾氣,則生成CO2的物質的量為2.5mol;
(4)尿素與NO2反應生成氮氣和二氧化碳氣體,反應的方程式為:4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
解答 解:(1)工業中,從合成塔出來的混合氣體成分是NH3、H2、N2;在進入分離器之前,需進入冷卻塔,故答案為:NH3、H2、N2;冷卻塔;
(2)根據可逆反應不可能完全轉化,如果3mol氫氣完全轉化生成2mol的氨氣,所以生成的氨氣的物質的量小于2mol,故選a;
(3)氨氣在工業制備硝酸生產中的作用氨氣與氧氣反應生成一氧化氮和水,反應的化學方程式為:4NH3+O2$\frac{\underline{\;\;\;催化劑\;\;\;}}{高溫高壓}$4NO+6H2O;由反應方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑可知,2mol的尾氣生成1mol的二氧化碳,所以每吸收5mol尾氣,則生成CO2的物質的量為2.5mol,故答案為:4NH3+O2$\frac{\underline{\;\;\;催化劑\;\;\;}}{高溫高壓}$4NO+6H2O;2.5mol;
(4)尿素與NO2反應生成氮氣和二氧化碳氣體,反應的方程式為:4CO(NH2)2+6NO2=7N2+4CO2+8H2O,故答案為:4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
點評 本題考查了含氮物質的應用,題目難度中等,明確工業制取硝酸的原理為解答關鍵,注意掌握含氮物質的性質及綜合應用方法,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:解答題
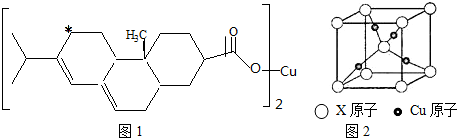
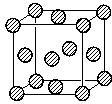 ,晶體密度為8.5g/cm3,求晶胞的邊長(只寫計算式,不求結果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶體密度為8.5g/cm3,求晶胞的邊長(只寫計算式,不求結果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
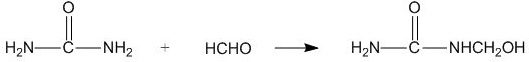
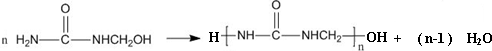
| A. | 合成脲醛塑料的反應為加聚反應 | |
| B. | 尿素與氰酸銨 ( NH4CNO ) 互為同系物 | |
| C. | 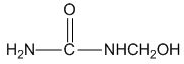 能發生水解反應 能發生水解反應 | |
| D. | 脲醛塑料平均相對分子質量為10000,平均聚合度為111 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氫化合物 | |
| C. | 甲烷、乙烷、丙烷在光照下分別與氯氣反應,生成的一氯代物都只有一種 | |
| D. | 乙醇、甲苯和溴苯可用水鑒別 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com