
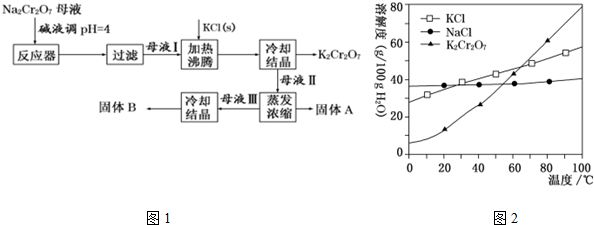
分析 由流程可知,溶解后調節pH除去少量雜質Fe3+,過濾后蒸發結晶得到Na2Cr2O7,然后加入KCl發生Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,結合溶解度圖可知,低溫下K2Cr2O7的溶解度較小,則冷卻結晶得到K2Cr2O7,母液II蒸發濃縮只有析出NaCl(A),母液Ⅲ冷卻結晶主要得到K2Cr2O7(B),以此來解答.
解答 解:由流程可知,溶解后調節pH除去少量雜質Fe3+,過濾后蒸發結晶得到Na2Cr2O7,然后加入KCl發生Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,結合溶解度圖可知,低溫下K2Cr2O7的溶解度較小,則冷卻結晶得到K2Cr2O7,母液II蒸發濃縮只有析出NaCl(A),母液Ⅲ冷卻結晶主要得到K2Cr2O7(B),
(1)確定母液中Fe3+已除盡的方法為取少量澄清母液于試管中,滴加少量堿液,若不產生紅褐色沉淀則母液中Fe3+已除盡(或向上層澄清母液繼續滴加堿液,若不產生紅褐色沉淀則母液中Fe3+已除盡),
故答案為:取少量澄清母液于試管中,滴加少量堿液,若不產生紅褐色沉淀則母液中Fe3+已除盡(或向上層澄清母液繼續滴加堿液,若不產生紅褐色沉淀則母液中Fe3+已除盡);
(2)由上述分析可知,母液Ⅰ的溶質主要為Na2Cr2O7,固體B為K2Cr2O7,故答案為:Na2Cr2O7;K2Cr2O7;
(3)流程中要得到母液Ⅲ和固體A的操作為蒸發濃縮、趁熱過濾,原因是減少K2Cr2O7 因降溫析出而損失,
故答案為:趁熱過濾;減少K2Cr2O7 因降溫析出而損失;
(4)①陽極上Fe失去電子生成亞鐵離子,具有還原性,則在以上處理過程中,Cr2O72-轉化為毒性較低的Cr3+的離子方程式為Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,
故答案為:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
②由Ksp Fe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31),已知電解后的溶液中c(Cr3+)為3×10-5mol•L-1,由$\frac{c({Fe}^{3+})}{c(C{r}^{3+})}=\frac{Ksp[Fe(OH)_{3}]}{Ksp[Cr(OH)_{3}]}$,則溶液中c(Fe3+)=$\frac{4.0×1{0}^{-38}}{6.0×1{0}^{-31}}×3×1{0}^{-5}$mol/L=2×10-12mol/L,
故答案為:2×10-12.
點評 本題考查混合物分離提純的綜合應用,為高頻考點,把握實驗流程中的反應、混合物分離方法為解答的關鍵,注意信息的應用及相關計算,側重分析與實驗、計算能力的綜合考查,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

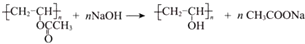
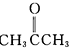 ”改為“乙醛”,經過②、③、④后得到以順式結構為主的高聚物,則用結構簡式表示其順式結構是
”改為“乙醛”,經過②、③、④后得到以順式結構為主的高聚物,則用結構簡式表示其順式結構是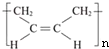 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
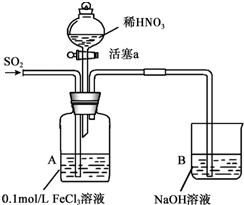 某化學小組探究酸性條件下NO3-、SO42-、Fe3+三種微粒的氧化性強弱,設計如下實驗(夾持儀器已略去,裝置的氣密性已檢驗).(忽略氧氣對反應的影響)
某化學小組探究酸性條件下NO3-、SO42-、Fe3+三種微粒的氧化性強弱,設計如下實驗(夾持儀器已略去,裝置的氣密性已檢驗).(忽略氧氣對反應的影響)| 實驗序號 | 實驗操作 | 實驗現象 |
| I | 向A裝置中通入一段時間的SO2氣體. | A中黃色溶液迅速變成深紅棕色,最終變為淺綠色. |
| II | 取出少量A裝置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不變色,再加入BaCl2溶液產生白色沉淀. |
| III | 打開活塞a,將過量稀HNO3加入裝置A中,關閉活塞a. | A中淺綠色溶液最終變為黃色. |
| IV | 取出少量A裝置中的溶液,加入KSCN溶液;向A裝置中注入空氣. | 溶液變為紅色;液面上方有少量紅棕色氣體生成. |
 Fe(OH)3+3H+,加入鹽酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入鹽酸,增大c(H+),平衡左移,抑制Fe3+水解. Fe(SO2)63+;而反應2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反應緩慢,但是反應限度較大,使溶液中c(Fe3+)降低,平衡逆向移動,紅棕色逐漸褪去,最終得到淺綠色溶液.
Fe(SO2)63+;而反應2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反應緩慢,但是反應限度較大,使溶液中c(Fe3+)降低,平衡逆向移動,紅棕色逐漸褪去,最終得到淺綠色溶液.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 不能用FeCl3 溶液鑒別水楊酸和阿司匹林 | |
| B. | 服用阿司匹林出現水楊酸反應時,可靜脈注射NaHCO3溶液 | |
| C. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| D. | 該反應不屬于取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硫具有漂白性,能使氯水褪色 | |
| B. | 濃硫酸具有較強酸性,能使Cu轉化為Cu2+ | |
| C. | 硅具有還原性,一定條件下能將鐵從其氧化物中置換出來 | |
| D. | 二氧化錳具有強氧化性,能將雙氧水氧化為氧氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濕潤淀粉碘化鉀試紙遇NO2變藍 | B. | 溴化銀見光分解變白 | ||
| C. | 熱的氧化銅遇乙醇變綠 | D. | 苯酚遇石蕊試液變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④ | B. | ②③⑤ | C. | ②③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com