
| A. | 單質鐵與水蒸氣的反應 | B. | 鋁片與氫氧化鈉溶液的反應 | ||
| C. | 過氧化鈉與二氧化碳的反應 | D. | 碳酸鈉溶液與稀鹽酸的反應 |
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
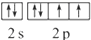 ,該元素的符號是O;
,該元素的符號是O;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
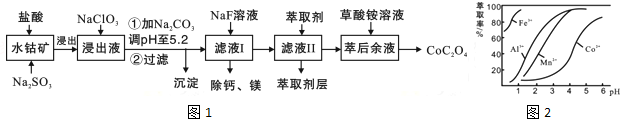
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
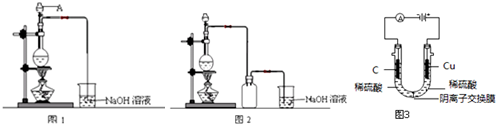
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④⑦⑧ | B. | ②③④⑥⑦ | C. | ③④⑥⑦⑧ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
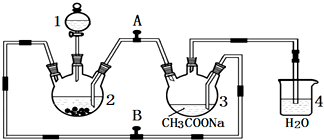
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
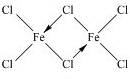 ,你認為該分子是否為平面形分子?否(填“是”或“否”).
,你認為該分子是否為平面形分子?否(填“是”或“否”).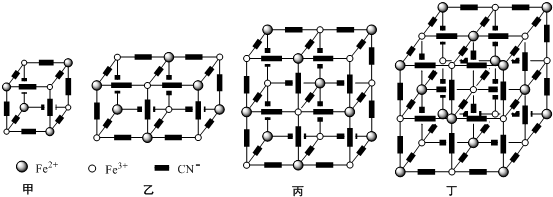
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
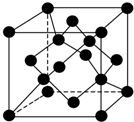 自然界存在豐富的碳、氮、硅、磷、鐵等元素,它們可形成單質及許多化合物.按要求回答下列問題:
自然界存在豐富的碳、氮、硅、磷、鐵等元素,它們可形成單質及許多化合物.按要求回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com