
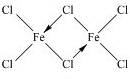
 ,你認為該分子是否為平面形分子?否(填“是”或“否”).
,你認為該分子是否為平面形分子?否(填“是”或“否”).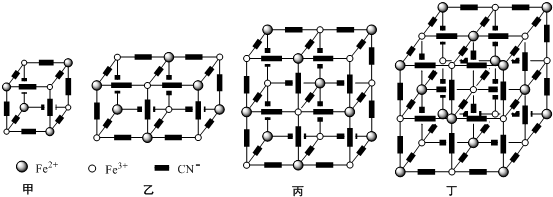
分析 (1)鐵是26號元素,核外電子排布式為1s22s22p63s23p63d64s2,失去4s能級2個電子形成Fe2+;
(2)二聚三氯化鐵(Fe2Cl6)分子的氣體,該分子中所有原子均滿足最外層8電子的穩定結構,Fe與氯原子之間形成4個共價鍵,有2個Cl原子形成分別與2個Fe原子之間形成2個共價鍵,存在配位鍵;鐵原子和四個氯原子形成四面體結構;
(3)K4[Fe(CN)6]中陰陽離子之間存在離子鍵,Fe3+和CN-之間存在配位鍵,CN-內原子之間形成共價鍵;
(4)原子數目相等、價電子總數相等的微粒互為電子,CN-與CO、N2等互為等電子體;等電子體結構相似,可知HCN的結構式為H-C≡N,C原子雜化軌道數目為2,單鍵為σ鍵,三鍵含有1個σ鍵、2個π鍵;
(5)利用均攤法計算立方體結構中Fe3+、Fe2+、CN-數目,結合電荷守恒計算K+數目,進而確定其化學式;
晶胞為其最小重復單位,一般情況下,晶胞都是平行六面體.整塊晶體可以看成是無數晶胞無隙并置而成的,要求晶胞的立方體八個頂點微粒相同.
解答 解:(1)鐵是26號元素,核外電子排布式為1s22s22p63s23p63d64s2,失去4s能級2個電子形成Fe2+,Fe2+離子的核外電子排布式為:1s22s22p63s23p63d6,
故答案為:1s22s22p63s23p63d6;
(2)二聚三氯化鐵(Fe2Cl6)分子的氣體,該分子中所有原子均滿足最外層8電子的穩定結構,Fe與氯原子之間形成4個共價鍵,有2個Cl原子形成分別與2個Fe原子之間形成2個共價鍵,存在配位鍵,所以其結構式為 ;
;
該分子中每個鐵原子生成四個共價鍵,則鐵原子和四個氯原子形成四面體結構,則該分子不是平面形結構,
故答案為 ;否;
;否;
(3)K4[Fe(CN)6]中陰陽離子之間存在離子鍵,Fe3+和CN-之間存在配位鍵,CN-內原子之間形成共價鍵,
故答案為:ABD;
(4)原子數目相等、價電子總數相等的微粒互為電子,CN-與CO、N2等互為等電子體;等電子體結構相似,可知HCN的結構式為H-C≡N,C原子雜化軌道數目為2,所以碳原子為sp雜化,單鍵為σ鍵,三鍵含有1個σ鍵、2個π鍵,分子中含有22個σ鍵、2個π鍵,
故答案為:CO;sp;2,2;
(5)立方體結構中Fe3+離子的個數為:4×$\frac{1}{8}$=$\frac{1}{2}$,Fe2+離子的個數為:4×$\frac{1}{8}$=$\frac{1}{2}$,CN-離子的個數為:12×$\frac{1}{4}$=3,
根據電荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),得N(K+)=$\frac{1}{2}$,
普魯士藍中 n(K+):n(Fe3+):n(Fe2+):n(CN-)=1:1:1:6,則其化學式為KFe2(CN)6;
晶胞為其最小重復單位,一般情況下,晶胞都是平行六面體.整塊晶體可以看成是無數晶胞無隙并置而成的,要求晶胞的立方體八個頂點微粒相同,圖象中丁符合,
故答案為:KFe2(CN)6;丁.
點評 本題考查了物質結構和性質,涉及晶胞的計算、等電子體、原子的雜化方式、配合物等知識點,掌握均攤法進行晶胞計算,識記中學常見晶胞結構,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質鐵與水蒸氣的反應 | B. | 鋁片與氫氧化鈉溶液的反應 | ||
| C. | 過氧化鈉與二氧化碳的反應 | D. | 碳酸鈉溶液與稀鹽酸的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 g重水中所含質子數為2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反應中,每生成32g氧氣,則轉移2NA個電子 | |
| C. | 銅與足量濃硫酸共熱放出4.48 LSO2時,消耗的銅原子數為0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有銅原子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備的晶體硅可用于制作計算機芯片 | |
| B. | 該法制備高純硅,可以綜合利用氯氣和氫氣,使原料循環利用,生產成本低,效率高 | |
| C. | 該過程是把硅轉化為SiHCl3與雜質分離,而后用氫氣還原得到高純硅 | |
| D. | 整個制備過程中若混有氧氣可以不除去 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
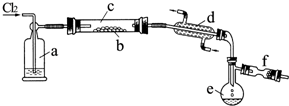 氯化硫(S2Cl2)是一種黃紅色液體,有刺激性、窒息性惡臭,熔點為-80℃,沸點137.1℃.在空氣中強烈發煙,易與水發生水解反應.人們使用它作橡膠硫化劑,使橡膠硫化,改變生橡膠熱發粘冷變硬的不良性能.在熔融的硫中通入氯氣即可生成S2Cl2.如圖是實驗室用S和Cl2制備S2Cl2的裝置(夾持裝置、加熱裝置均已略去).
氯化硫(S2Cl2)是一種黃紅色液體,有刺激性、窒息性惡臭,熔點為-80℃,沸點137.1℃.在空氣中強烈發煙,易與水發生水解反應.人們使用它作橡膠硫化劑,使橡膠硫化,改變生橡膠熱發粘冷變硬的不良性能.在熔融的硫中通入氯氣即可生成S2Cl2.如圖是實驗室用S和Cl2制備S2Cl2的裝置(夾持裝置、加熱裝置均已略去).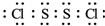 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鉻、釩、鐠(Pr)、鈰(Ce)等金屬在工農業生產中有廣泛的應用.
鉻、釩、鐠(Pr)、鈰(Ce)等金屬在工農業生產中有廣泛的應用.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com