
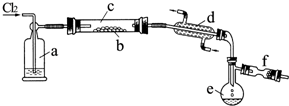
 氯化硫(S2Cl2)是一種黃紅色液體,有刺激性、窒息性惡臭,熔點為-80℃,沸點137.1℃.在空氣中強烈發煙,易與水發生水解反應.人們使用它作橡膠硫化劑,使橡膠硫化,改變生橡膠熱發粘冷變硬的不良性能.在熔融的硫中通入氯氣即可生成S2Cl2.如圖是實驗室用S和Cl2制備S2Cl2的裝置(夾持裝置、加熱裝置均已略去).
氯化硫(S2Cl2)是一種黃紅色液體,有刺激性、窒息性惡臭,熔點為-80℃,沸點137.1℃.在空氣中強烈發煙,易與水發生水解反應.人們使用它作橡膠硫化劑,使橡膠硫化,改變生橡膠熱發粘冷變硬的不良性能.在熔融的硫中通入氯氣即可生成S2Cl2.如圖是實驗室用S和Cl2制備S2Cl2的裝置(夾持裝置、加熱裝置均已略去).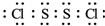 .
.分析 (1)S2Cl2分子結構與H2O2相似,S2Cl2分子中氯原子與硫原子之間形成1對共用電子對,硫原子與硫原子之間形成1對共用電子對;
(2)根據儀器的形狀確定名稱,由信息可知S2Cl2遇水水解,進入b中的氣體應該干燥,用濃硫酸干燥;
(3)加熱之前先通冷凝水,否則開始生成的S2Cl2不能冷卻液化,最后先停止加熱后停止通氯氣,平衡容器內壓強,防止發生危險;
(4)f裝置盛放堿石灰,吸收Cl2尾氣,防止空氣中的水汽加入e中;
(5)只有硫元素化合價發生變化,根據被氧化和被還原的該元素的物質的量之比為1:3書寫.
解答 解:(1)S2Cl2分子結構與H2O2相似,S2Cl2分子中氯原子與硫原子之間形成1對共用電子對,硫原子與硫原子之間形成1對共用電子對,S2Cl2電子式為 ,故答案為:
,故答案為: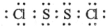 ;
;
(2)由信息可知S2Cl2遇水水解,進入b中的氣體應該干燥,濃硫酸具有吸水性且與氯氣不反應,所以a中應放試劑為濃硫酸,其作用為干燥氯氣,裝置c為何水平放置是為防止熔融的硫堵塞導管,
故答案為:濃H2SO4;干燥Cl2;防止熔融的硫堵塞導管;
(3)加熱之前先通冷凝水,否則開始生成的S2Cl2不能冷卻液化,最后先停止加熱后停止通氯氣,平衡容器內壓強,防止發生危險.所以實驗操作順序為②③①⑤④(或③②①⑤④);
故答案為:②③①⑤④(或③②①⑤④);
(4)氯氣有毒,為酸性氣體,f裝置盛放堿石灰,吸收Cl2尾氣,防止污染環境,防止空氣中的水汽加入e中使S2Cl2水解,
故答案為:堿石灰;吸收Cl2尾氣,防止污染環境,防止空氣中的水汽加使S2Cl2水解;
(5)只有硫元素化合價發生變化,反應中硫元素從+1價部分變為+4價,得氧化產物為SO2,部分變為0價,得還原產物為S,且被氧化和被還原的物質的量之比為1:3,化學方程式為2S2Cl2+2H2O=SO2↑+3S↓+4HCl,
故答案為:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
點評 本題考查制備實驗方案的設計,為高頻考點,把握制備實驗原理、實驗裝置的作用、習題中的信息為解答的關鍵,側重分析與實驗能力的綜合考查,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
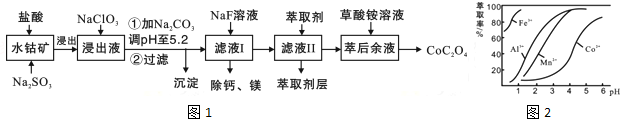
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
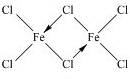 ,你認為該分子是否為平面形分子?否(填“是”或“否”).
,你認為該分子是否為平面形分子?否(填“是”或“否”).
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

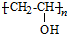 、CH3CH2CH2CHO.
、CH3CH2CH2CHO. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
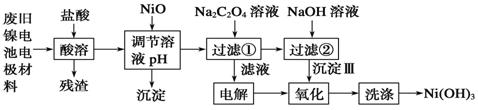
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 給試管中的銅與濃硫酸加熱,發現試管底部有白色固體并夾雜有少量黑色物質,此白色固體為硫酸銅,黑色固體為氧化銅 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黃色變為淺綠色,但立即又變成棕黃色,說明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 配制一定物質的量濃度溶液時發現濃度偏低,可能由于配制溶液所用的容量瓶事先未干燥 | |
| D. | 濃硝酸在光照條件下變黃,說明濃硝酸不穩定,生成的有色產物能溶于濃硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 自然界存在豐富的碳、氮、硅、磷、鐵等元素,它們可形成單質及許多化合物.按要求回答下列問題:
自然界存在豐富的碳、氮、硅、磷、鐵等元素,它們可形成單質及許多化合物.按要求回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合物中含有0.05molFe元素 | |
| B. | 該硝酸溶液中溶質的質量分數是63% | |
| C. | 所加入NaOH溶液的體積最少是450mL | |
| D. | 反應中HNO3被氧化,生成氧化產物NO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
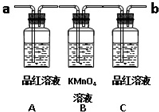 已知二氧化硫可使高錳酸鉀溶液褪色,用如圖裝置(部分裝置沒畫出)來驗證某混合氣體中同時含有SO2和CO2.
已知二氧化硫可使高錳酸鉀溶液褪色,用如圖裝置(部分裝置沒畫出)來驗證某混合氣體中同時含有SO2和CO2.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com