
分析 (1)三價鐵離子具有強的氧化性能夠氧化硫化氫生成單質硫;
(2)陰極二價鐵離子失去1個電子生成三價鐵離子;
(3)結合綠色化學的理論并根據FeCl3可以循環利用確定該實驗的有兩個顯著優點;
解答 解:(1)FeCl3與H2S反應生成硫單質、二價鐵離子和水,離子方程式為 2Fe3++H2S=2Fe2++S↓+2H+;
故答案為:2Fe3++H2S=2Fe2++S↓+2H+;
(2)陰極二價鐵離子失去1個電子生成三價鐵離子,電極反應式:Fe2+-e-=Fe3+;
故答案為:Fe2+-e--=Fe3+;
(3)根據實驗原理可知,電解池中最終得到的FeCl3可重新用來吸收H2S,得到循環利用,
故答案為:FeCl3可以循環利用.
點評 本題考查了離子方程式、電極反應式的書寫,明確三價鐵離子性質、電解池工作原理是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:解答題
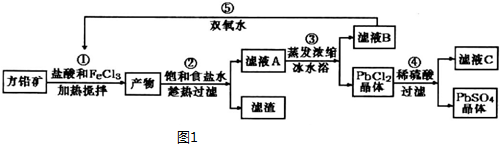
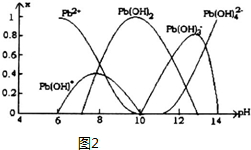
| 離子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 處理前濃度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 處理后濃度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④⑦⑧ | B. | ②③④⑥⑦ | C. | ③④⑥⑦⑧ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
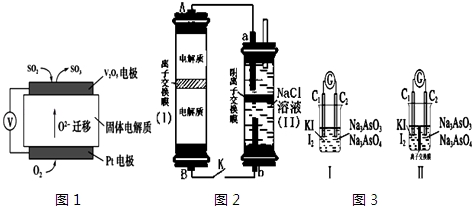
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
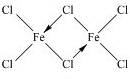 ,你認為該分子是否為平面形分子?否(填“是”或“否”).
,你認為該分子是否為平面形分子?否(填“是”或“否”).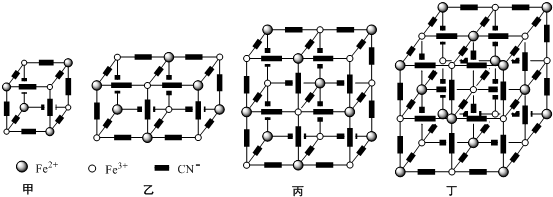
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
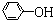 )具有弱酸性,其Ka=1.1×10-10;水楊酸第一級電離形成的離子
)具有弱酸性,其Ka=1.1×10-10;水楊酸第一級電離形成的離子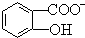 能形成分子內氫鍵.據此判斷,相同溫度下電離平衡常數Ka2(水楊酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子內氫鍵.據此判斷,相同溫度下電離平衡常數Ka2(水楊酸)<Ka(苯酚)(填“>”或“<”),其原因是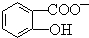 中形成分子內氫鍵,使其更難電離出H+.
中形成分子內氫鍵,使其更難電離出H+.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

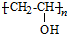 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.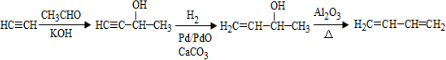 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 給試管中的銅與濃硫酸加熱,發現試管底部有白色固體并夾雜有少量黑色物質,此白色固體為硫酸銅,黑色固體為氧化銅 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黃色變為淺綠色,但立即又變成棕黃色,說明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 配制一定物質的量濃度溶液時發現濃度偏低,可能由于配制溶液所用的容量瓶事先未干燥 | |
| D. | 濃硝酸在光照條件下變黃,說明濃硝酸不穩定,生成的有色產物能溶于濃硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 離子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物質的量濃度(mol/L) | 1 | 1 | a | 1 |
| A. | 陽極生成1.5mol Cl2 | B. | a=3 | ||
| C. | 電解后溶液中c(H+)=1moL/L | D. | 陰極析出的金屬是銅與鋁 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com