
分析 (1)一水合氨是弱電解質,加水稀釋促進其電離,加水稀釋100倍,溶液中c(OH-)大于原來的$\frac{1}{100}$;(2)向氨水中加入氯化銨,銨根離子濃度增大而抑制一水合氨電離;
(3)離子積常數只與溫度有關,與溶液酸堿性及濃度無關;氯化銨促進水電離,銨根離子水解導致溶液呈酸性,氯化銨溶液中水電離出的c(H+)=10-pH;
(4)若將0.1mol NH4Cl和0.05mol NaOH全部溶于水形成混合溶液,溶液中存在NH4+和NH3•H2O,結合物料守恒和電荷守恒解答.
解答 解:(1)一水合氨是弱電解質,加水稀釋促進其電離,加水稀釋100倍,溶液中c(OH-)大于原來的$\frac{1}{100}$,所以在25℃條件下,將pH=11的氨水稀釋100倍后溶液的pH大于9而小于11,故答案為:D;
(2)向氨水中加入氯化銨,銨根離子濃度增大而抑制一水合氨電離,導致溶液中c(OH-)減小,溶液的pH減小,故答案為:C;
(3)離子積常數只與溫度有關,與溶液酸堿性及濃度無關,所以c(H+)•c(OH-)=10-14mol2•L-2;氯化銨促進水電離,銨根離子水解導致溶液呈酸性,氯化銨溶液中水電離出的c(H+)=10-pH=10-5mol/L,
故答案為:10-14;10-5;
(4)①根據N原子守恒可知,溶液中NH3•H2O和NH4+兩種粒子的物質的量之和等于0.1mol,故答案為:NH3•H2O;NH4+;
②根據電荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),則c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol,故答案為:NH4+;H+.
點評 本題考查弱電解質電離和鹽類水解,為高頻考點,側重考查學生分析計算能力,把握溶液中溶質及其性質是解本題關鍵,注意電荷守恒及物料守恒的正確靈活運用,注意:離子積常數只與溫度有關,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | ①⑥ | B. | ③⑤ | C. | ④⑥⑦ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下,將稀氨水逐滴加入稀硫酸中,當溶液pH=7時,c(SO42-)>c(NH4+) | |
| B. | 室溫下,pH=3的氫氟酸加水稀釋后,溶液pH減小 | |
| C. | 室溫下,pH=11的NaOH溶液與pH=3的醋酸溶液等體積混合,滴入石蕊溶液呈紅色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸銨固體,則溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 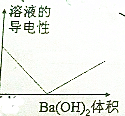 | B. | 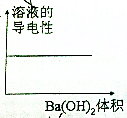 | ||
| C. | 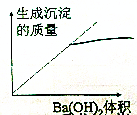 | D. | 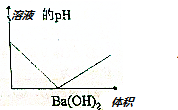 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質鐵與水蒸氣的反應 | B. | 鋁片與氫氧化鈉溶液的反應 | ||
| C. | 過氧化鈉與二氧化碳的反應 | D. | 碳酸鈉溶液與稀鹽酸的反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com