
分析 (1)根據配制步驟是計算、稱量、溶解、移液、洗滌、定容、搖勻、裝瓶來分析需要的儀器;
(2)依據配制一定物質的量濃度溶液的一般步驟解答;
(3)①根據c=$\frac{1000ρω}{M}$計算出98%的濃硫酸(ρ=1.84g•cm-3)的物質的量濃度;依據稀釋前后溶液含溶質的物質的量不變計算需要濃硫酸的體積;
②根據量取濃硫酸的體積,選擇與量筒的規格最接近的量筒;根據量取的濃硫酸相當于被稀釋了分析;
③濃硫酸稀釋過程中放出熱量暴沸,攪拌過程中有液體濺出,會使配制的溶液的溶質減小;
④在轉入容量瓶前燒杯中液體未冷卻,體積偏大,冷卻后體積偏小,定容時俯視,溶液的液面在刻度線以下,導致溶液體積偏小,結合c=$\frac{n}{V}$判斷.
解答 解:①操作步驟有計算、稱量、溶解、移液、洗滌、定容、搖勻等操作,一般用量筒量取,在燒杯中溶解,并用玻璃棒攪拌,加速溶解.冷卻后轉移到500mL容量瓶中(無450ml規格的容量瓶),并用玻璃棒引流,洗滌燒杯、玻璃棒2-3次,并將洗滌液移入容量瓶中,加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,最后定容顛倒搖勻.所以所需的玻璃儀器有量筒、燒杯、玻璃棒、500mL容量瓶、膠頭滴管.根據提供的儀器可知,還需儀器有500mL容量瓶,
故答案為:500mL容量瓶;
(2)配制500mL 0.5mol/L的稀硫酸溶液的步驟為:計算、稱量、溶解、轉移、洗滌、定容、搖勻等,所以正確的配制順序為A、D、E、C、B,
故答案為:A、D、E、C、B;
(3)①98%的濃硫酸(ρ=1.84g•cm-3)的物質的量濃度為:c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,稀釋前后溶液含溶質的物質的量不變,設需要濃硫酸體積為V,則V×18.4mol/L=0.5mol/L×500mL,解得:V=13.6ml,
故答案為:18.4 mol/L;13.6;
②量取13.6mL濃硫酸,需要使用15mL的量筒;量取時發現量筒不干凈用水洗凈后直接量取,濃硫酸被蒸餾水稀釋,導致濃硫酸的濃度偏低,
故答案為:15;偏低;
③濃硫酸稀釋放熱,溶液的溫度升高,轉移前必須冷卻稀釋的溶液,否則導致配制的溶液溫度較高暴沸,體積偏大,冷卻后配制的溶液的體積偏低,最終導致濃度偏高,若攪拌過程中有液體濺出,溶質物質的量減小,濃度偏低,
故答案為:防止暴沸,迅速散熱;偏低;
④在轉入容量瓶前燒杯中液體應先冷卻,未冷卻體積偏大,定容后冷卻體積偏小,濃度偏大,定容時俯視刻度線,導致所配溶液的液體體積偏小,濃度偏高,
故答案為:偏高;偏高.
點評 本題考查了一定物質的量濃度溶液的配制,題目難度不大,根據c=$\frac{n}{V}$,理解溶液配制原理與誤差分析,注意濃硫酸的稀釋方法.


科目:高中化學 來源: 題型:選擇題
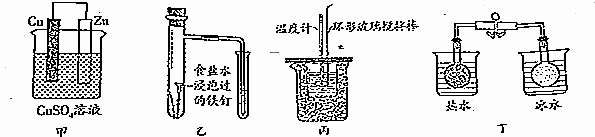
| A. | 圖甲所示的實驗:根據溶液顏色變化可比較Zn、Cu的金屬活動性 | |
| B. | 圖乙所示的實驗:根據小試管中液面的變化判斷鐵釘發生析氫腐蝕 | |
| C. | 圖丙所示的實驗:根據溫度計讀數的變化用濃硫酸和Na0H反應測定中和熱 | |
| D. | 圖丁所示的實驗:根據兩燒瓶中氣體顏色的變化判斷2N02(g)?N20(g)是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |
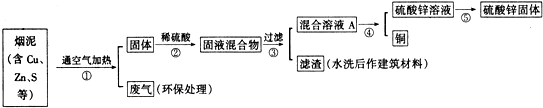
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
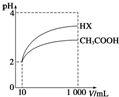
| A. | 0.1mol/LCH3COOH溶液,加水稀釋過程中,所有離子濃度均減小 | |
| B. | 濃度均為0.1mol/L的NaF、CH3COONa溶液相比較,CH3COONa溶液pH大 | |
| C. | 反應HF+CH3COONa═NaF+CH3COOH可以發生 | |
| D. | NaF溶液中加少量NaOH固體,溶液中c(F-)變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 25℃時,部分物質的電離平衡常數如表所示:
25℃時,部分物質的電離平衡常數如表所示:| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合價 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | B元素不能形成共價化合物 | |
| B. | 離子半徑大小A+>D2- | |
| C. | A和E形成的化合物中只可能含離子鍵 | |
| D. | B和E的化合物不能溶于氨水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com