
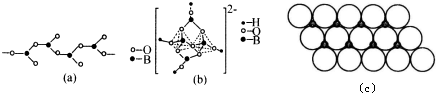
分析 (1)Cu原子失去1個電子生成Cu+,Cu+核外有28個電子,失去的電子數是其最外層電子數,根據構造原理書寫Cu+基態核外電子排布式;
(2)A.N5+是由N5分子失去1個電子得到的,1個N5分子是由5個氮原子構成的,據此進行分析解答.
B.N5+離子中每個氮原子均滿足8電子結構,每個N原子形成3個共用電子對,還剩一對未成鍵電子;
C.N5+離子的結構為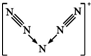 ;
;
(3)①由方程式可知:碳元素由CH4變為CO2,碳原子雜化類型由sp3轉化為sp;
②根據無機苯中氮原子和硼原子都采取sp2雜化分析;
(4)有1個O連著一個B,剩余的兩個O分別連著2個B,說明有一個O完全屬于B,剩下的兩個O,B只占有O的$\frac{1}{2}$;硼砂晶體中陰離子[B4O5(OH)4]2-中一半sp3雜化形成BO4四面體;另一種是sp2雜化形成BO3平面三角形結構;
(5)根據氯化鈉的結構知,氧離子和相鄰的鎳離子之間的距離為 $\frac{1}{2}$a,距離最近的兩個陽離子核間的距離是距離最近的氧離子和鎳離子距離的 $\sqrt{2}$倍,根據圖片知,每個氧化鎳所占的面積=1.40×10-10m×1.40×10-10m×sin60°,每個氧化鎳的質量=$\frac{74.7}{N{\;}_{A}}$g,每個氧化鎳的質量乘以每平方米含有的氧化鎳個數就是每平方米含有的氧化鎳質量.
解答 解:(1)Cu原子失去1個電子生成Cu+,Cu+核外有28個電子,失去的電子數是其最外層電子數,根據構造原理知Cu+基態核外電子排布式1s22s22p63s23p63d10或[Ar]3d10 ,故答案為:1s22s22p63s23p63d10或[Ar]3d10 ;
(2)A.1個氮原子中含有7個電子,則1個N5分子中含有35個電子,N5+是由N5分子失去1個電子得到的,則1個N5+粒子中有34個電子,故A錯誤;
B.N5+離子中每個氮原子均滿足8電子結構,每個N原子形成3個共用電子對,還剩一對未成鍵電子,所以N5+離子中存在五對未成鍵的電子對,故B錯誤;
C.N5+離子的結構為 ,則N5+陽離子中存在兩個氮氮三鍵,故C正確;
,則N5+陽離子中存在兩個氮氮三鍵,故C正確;
故選:C;
(3)①3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,
A.由CH4變為CO2,碳原子雜化類型由sp3轉化為sp,反應前后碳原子的軌道雜化類型已經改變,故A錯誤;
B.CH4分子中價層電子對=σ 鍵電子對+中心原子上的孤電子對=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤電子對,所以其空間構型是正四面體,H2O中價層電子對個數=2+$\frac{1}{2}$×(6-2×1)=4,且含有2個孤電子對,所以H2O的VSEPR模型為四面體,分子空間構型為V型,、CO2分子中價層電子對=σ 鍵電子對+中心原子上的孤電子對=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直線型結構,故B正確;
C.同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第IIA族、第VA族元素的第一電離能大于相鄰元素,這幾種元素都是第二周期元素,它們的族序數分別是:第IIIA族、第IVA族、第VA族、第VIA族,所以它們的第一電離能大小順序是I1(N)>I1(O)>I1(C)>I1(B),故C正確;
D.B一般是形成3個鍵,(H3BNH3)由六元環狀化合物(HB=NH)3通過3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1個鍵是配位鍵,故D正確;
故答案為:A;
②1個(HB=NH)3分子中硼原子與氮原子間以σ鍵結合,而剩余的p軌道形成一個共軛大π鍵.B-H鍵有3個,N-H鍵有3個,B-N有σ鍵有6個,故一共12個;
故答案為:12;
(4)圖(a)是一種鏈狀結構的多硼酸根,從圖可看出,每個BO32-單元,都有一個B,有一個O完全屬于這個單元,剩余的2個O分別為2個BO32-單元共用,所以B:O=1:(1+2×$\frac{1}{2}$)=1:2,化學式為:[BO2]nn-(或BO2-),從圖(b)是硼砂晶體中陰離子的環狀結構可看出,[B4O5(OH)4]2-一半sp3雜化形成兩個四配位BO4四面體;另一半是sp2雜化形成兩個三配位BO3平面三角形結構,
故答案為:[BO2]nn-(或BO2-);sp2、sp3.
(5)根據氯化鈉的結構知,氧離子和相鄰的鎳離子之間的距離為 $\frac{1}{2}$a,距離最近的兩個陽離子核間的距離是距離最近的氧離子和鎳離子距離的 $\sqrt{2}$倍,所以其距離是 $\frac{\sqrt{2}}{2}$acm;
根據圖片知,每個氧化鎳所占的面積=$\frac{4×1.40×10{\;}^{-10}m×8×1.40×10{\;}^{-10}m×sin60°}{8}$,則每平方米含有的氧化鎳個數=$\frac{1}{4×1.4×10{\;}^{-10}×1.4×10{\;}^{-10}Sin60°}$,每個氧化鎳的質量=$\frac{74.7}{N{\;}_{A}}$g,所以每平方米含有的氧化鎳質量=$\frac{74.7}{N{\;}_{A}}$g×$\frac{1}{4×1.4×10{\;}^{-10}×1.4×10{\;}^{-10}Sin60°}$=1.83×10-3,
故答案為:$\frac{\sqrt{2}}{2}$a;1.83×10-3.
點評 本題考查學生對物質結構與性質模塊的掌握情況,重點考查結構知識,涉及電離能、電子排布式、原子半徑、空間結構、雜化軌道、化學式、晶體的計算等,考查知識全面、覆蓋廣,難度適中,可以衡量學生對該模塊主干知識的掌握情況.


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案科目:高中化學 來源: 題型:解答題

 $→_{△}^{濃硫酸}$
$→_{△}^{濃硫酸}$ +H2O,反應類型為消去反應
+H2O,反應類型為消去反應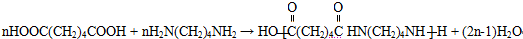 ,反應類型為縮聚反應
,反應類型為縮聚反應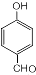 ,T的分子式為C2H4O
,T的分子式為C2H4O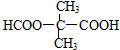 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
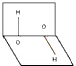
| A. | 分子的正、負電荷重心重合 | B. | 分子正、負電荷重心不重合 | ||
| C. | H2O2是極性分子 | D. | H2O2是非極性分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室有一瓶混有氯化鈉的氫氧化鈉固體試劑,經測定氫氧化鈉的質量分數約為82%,為了驗證其純度,用濃度為0.2mol•L-1的鹽酸進行滴定,完成下列問題:
實驗室有一瓶混有氯化鈉的氫氧化鈉固體試劑,經測定氫氧化鈉的質量分數約為82%,為了驗證其純度,用濃度為0.2mol•L-1的鹽酸進行滴定,完成下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11.2 LO2和O3組成的混合氣體含有原子數為NA | |
| B. | 常溫常壓下,1.7 g NH3含有的電子數目為 NA | |
| C. | 0.1mol/LNa2SO4溶液中含有Na+的個數為0.2NA | |
| D. | 標準狀況下,22.4 L NO2與足量的H2O充分反應后轉移電子數為 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com