
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
分析 等物質的量濃度的NaOH和Na2CO3的混合溶液中含有氫氧化鈉與碳酸鈉的物質的量相等,稀鹽酸加入到NaOH和Na2CO3的混合溶液中,鹽酸先與氫氧化鈉發(fā)生酸堿中和,剩余的鹽酸再與碳酸鈉發(fā)生反應,鹽酸少量時發(fā)生反應CO32-+H+=HCO3-,鹽酸過量時發(fā)生反應:CO32-+2H+=CO2↑+H2O,以此來解答.
解答 解:A.設NaOH和Na2CO3的物質的量都為1mol,則加入鹽酸少量,先發(fā)生反應:OH-+H+→H2O,1mol氫氧化鈉消耗1mol鹽酸,再發(fā)生反應CO32-+H+→HCO3-,將兩個方程式相加得:OH-+CO32-+2H+→HCO3-+H2O,故A錯誤;
B.設NaOH和Na2CO3的物質的量都為2mol,則加入鹽酸少量,先發(fā)生反應:2OH-+2H+→2H2O,2mol氫氧化鈉消耗2mol鹽酸,再發(fā)生反應CO32-+H+→HCO3-,鹽酸不足之消耗1mol碳酸鈉,將兩個方程式相加得:2OH-+CO32-+3H+→HCO3-+2H2O,故B正確;
C.設NaOH和Na2CO3的物質的量都為2mol,2mol氫氧化鈉消耗2mol氫離子,剩余2mol氫離子與2mol碳酸鈉反應生成2mol碳酸氫根離子,離子方程式應為2OH-+2CO32-+4H+→2HCO3-+2H2O,即OH-+CO32-+2H+→HCO3-+H2O,故C錯誤;
D.設NaOH和Na2CO3的物質的量都為1mol,則加入鹽酸過量,先發(fā)生反應:OH-+H+→H2O,1mol氫氧化鈉消耗1mol鹽酸,再發(fā)生反應CO32-+2H+→CO2↑+H2O,將兩個方程式相加得:OH-+CO32-+3H+→CO2↑+2H2O,故D正確;
故選BD.
點評 本題考查離子反應方程式書寫的正誤判斷,為高頻考點,把握反應的先后順序、與量有關的離子反應為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 以惰性材料為電極,KOH溶液為電解質構成原電池,負極反應式為H2-2e-=2H+ | |
| B. | 銅、鋅在稀硫酸溶液中構成原電池,正極反應式為2H++2e-=H2↑ | |
| C. | 以銅為電極將2Fe3++Cu=2Fe2++Cu2+設計成原電池,正極反應式為Cu-2e-=Cu2+ | |
| D. | 以鋁、鐵為電極,在氫氧化鈉溶液中構成原電池,負極反應式為Al-3e-=Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 最易失去的電子能量最高 | |
| B. | L層電子比K層電子能量高 | |
| C. | p軌道電子能量一定高于s軌道電子能量 | |
| D. | 在離核最近區(qū)域內運動的電子能量最低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
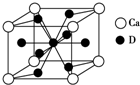 A、B、C、D是元素周期表中前36號元素,它們的核電荷數(shù)依次增大.第二周期元素A原子的核外成對電子數(shù)是未成對電子數(shù)的2倍且有3個能級,B原子的最外層p軌道的電子為半充滿結構,C是地殼中含量最多的元素.D是第四周期元素,其原子核外最外層電子數(shù)與氫原子相同,其余各層電子均充滿.請回答下列問題:
A、B、C、D是元素周期表中前36號元素,它們的核電荷數(shù)依次增大.第二周期元素A原子的核外成對電子數(shù)是未成對電子數(shù)的2倍且有3個能級,B原子的最外層p軌道的電子為半充滿結構,C是地殼中含量最多的元素.D是第四周期元素,其原子核外最外層電子數(shù)與氫原子相同,其余各層電子均充滿.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO3 2-離子數(shù)之和為0.1NA | |
| B. | 標準狀況下,22.4LC2H4與C3H6混合氣體所含有分子數(shù)為NA | |
| C. | 1molNa2O2與足量的CO2反應轉移的電子數(shù)為2NA | |
| D. | 18gNH4+所含的電子數(shù)11NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 測定次數(shù) | 鹽酸的體積/mL | KOH溶液的體積 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA體積的關系曲線如圖所示,有關離子濃度的大小關系正確的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA體積的關系曲線如圖所示,有關離子濃度的大小關系正確的是( )| A. | 在A、B間任意一點(不包括A、B兩點):c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 在B點:c(A-)=c(K+)>c(OH-)=c(H+),且a=7.5 | |
| C. | 在C點:c(A-)>c(K+)>c(OH-)>c(H+) | |
| D. | 在D點:c(A -)+c(HA)>2 c(K+) |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com