
| 測定次數 | 鹽酸的體積/mL | KOH溶液的體積 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
分析 (1)配制100mL 1.5mol/L-1KOH溶液,必須使用規格為100mL的容量瓶;
(2)①根據反應結束前溶液為無色,反應結束時溶液為淺紅色判斷滴定終點;
②分別計算出三次滴定消耗氫氧化鉀溶液的體積,然后計算出平均值,最后根據中和反應實質計算出稀釋后鹽酸的濃度,然后根據稀釋過程中溶質的物質的量不變計算出36.5%鹽酸濃度.
解答 解:(1)配制100mL 1.5mol/L-1KOH溶液時,需要用的玻璃儀器有:燒杯、玻璃棒、膠頭滴管和100mL容量瓶,所以還缺少規格為100mL的容量瓶,
故答案為:100mL容量瓶;
(2)①用氫氧化鉀溶液滴定鹽酸,反應結束前溶液為無色,滴定結束時溶液為淺紅色,則滴定終點的現象為:溶液由無色變為淺紅色,且半分鐘內不褪色,
故答案為:溶液由無色變為淺紅色,且半分鐘內不褪色;
②計算出三次滴定消耗氫氧化鉀溶液的體積分別為:21.03mL-1.02mL=20.01mL、21.99mL-2.0mL=19.99mL、20.20mL-0.02mL=20.00mL,所以三次滴定消耗氫氧化鉀溶液的平均體積為:$\frac{20.01mL+19.99mL+20.00mL}{3}$=20.0mL,
則稀釋后該鹽酸的物質的量濃度為:$\frac{1.5mol/L×0.02L}{0.025L}$=1.2mol/L,稀釋過程中溶質的物質的量不變,則稀釋前鹽酸濃度為:$\frac{1.2mol/L×0.2L}{0.02L}$=12mol/L,即:36.5%鹽酸濃度為12mol/L,
故答案為:12mol/L.
點評 本題考查了中和滴定,題目難度不大,明確中和滴定原理及操作方法為解答關鍵,注意掌握滴定終點現象的判斷方法,試題培養了學生的分析能力及化學實驗能力.


 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 原子序數=原子核內質子數 | |
| B. | 元素的種數=原子種數 | |
| C. | 元素周期表中主族序數=原子的最外層電子數 | |
| D. | 元素周期表中周期數=原子的電子層數 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
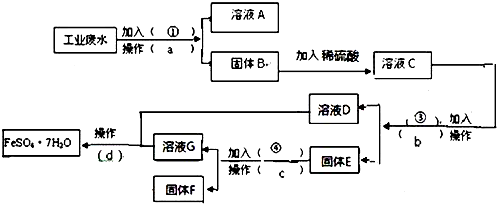
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚乙烯食品包裝袋、食物保鮮膜都是無毒的高分子化合物 | |
| B. | 高純度的二氧化硅廣泛用于制作光導纖維,遇強堿會“斷路” | |
| C. | 煤經過氣化和液化兩種物理變化,可變為清潔能源 | |
| D. | 加熱能殺死甲型H1N1流感病毒,主要是加熱后使病毒中的蛋白質變性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
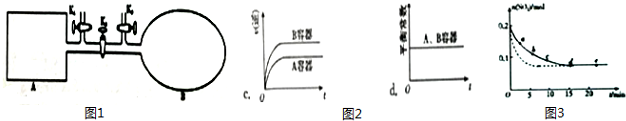
| 編號 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28g乙烯中存在的電子總數為12NA | |
| B. | 標準狀況下,22.4LHF的物質的量為1mol | |
| C. | 鉛蓄電池電解氯化鈉溶液,得到標況下22.4L氫氣,理論上鉛蓄電池中消耗氫離子個數為4NA | |
| D. | lmol的Na2C03溶于鹽酸形成混合溶液1L,常溫下在pH=4時,c(CO32- )+c(H2C03)=0.lmol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com