
| A. | R的氧化物都能溶于水 | |
| B. | R的最高價氧化物對應的水化物都是H2RO4 | |
| C. | R一定是非金屬元素 | |
| D. | R的最高價氧化物都能與NaOH溶液反應 |
分析 R代表短周期元素,R原子最外層的p亞層上的未成對電子只有2個,則R的價層電子排布可能為2s22p2、2s22p4、3s23p2、3s23p4,可能為C、O、Si、S等元素,結合元素對應的單質、化合物的性質解答.
解答 解:R原子最外層的p亞層上的未成對電子只有2個,則R的價層電子排布可能為2s22p2、2s22p4、3s23p2、3s23p4,可能為C、O、Si、S等元素,則
A.如R為Si,對應的氧化物SiO2不能溶于水,故A錯誤;
B.如R為C、Si,則R的最高價氧化物所對應的水化物是H2SO3,故B錯誤;
C.R可能為C、O、Si、S等元素,一定是非金屬元素,故C正確;
D.如R為C,對應的氧化物有CO,為不成鹽氧化物,不能與NaOH溶液反應,故D錯誤.
故選C.
點評 本題考查原子結構與元素周期律的關系,為高頻考點,側重于學生的分析能力的考查,題目難度不大,本題注意把握常見元素的核外電子排布,根據核外電子排布特點正確判斷元素的種類,把握常見元素化合物的性質.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | CH2═CH-C6H5分子中的所有原子可能共平面 | |
| C. | 乙烷分子中的所有原子可能共平面 | |
| D. | 二氯甲烷分子為正四面體結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度℃ | 10 | 30 | 60 | 90 |
| 濃度(mol/L) | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
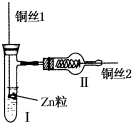 如圖為氫氣還原氧化銅的微型快速實驗裝置.實驗前先將銅絲1處理成下端彎曲的小圓環,并用鐵錘擊成帶小孔的小匙,將銅絲2一端彎曲成螺旋狀.試回答下列問題:
如圖為氫氣還原氧化銅的微型快速實驗裝置.實驗前先將銅絲1處理成下端彎曲的小圓環,并用鐵錘擊成帶小孔的小匙,將銅絲2一端彎曲成螺旋狀.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
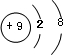 ,該元素與金屬性最強的元素形成的化合物的電子式為
,該元素與金屬性最強的元素形成的化合物的電子式為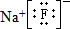 ;該化合物中存在的化學鍵為離子鍵 (選填“離子鍵”或“共價鍵”).
;該化合物中存在的化學鍵為離子鍵 (選填“離子鍵”或“共價鍵”).查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 A、B、C、D、E五種元素均位于前四周期,原子序數逐漸增大,只有兩種是金屬元素.A、B、D三種元素在周期表中相對位置如圖,其中A的價層電子排布為ns2np3,C的基態原子的第I電離能遠小于第II電離能.E是第四期第IB族元素,回答下列問題:
A、B、C、D、E五種元素均位于前四周期,原子序數逐漸增大,只有兩種是金屬元素.A、B、D三種元素在周期表中相對位置如圖,其中A的價層電子排布為ns2np3,C的基態原子的第I電離能遠小于第II電離能.E是第四期第IB族元素,回答下列問題:| A | B | |
| D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 若pH=7,HA的濃度一定為0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒濃度關系為:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA為強酸時,HA的濃度應為0.08 mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com