
| 難溶電解質 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
分析 ①中為了不引入其他雜質離子,應加氨水使Fe3+沉淀,而不能用氫氧化鈉溶液;
②中根據溶解度表可知Mg(OH)2易轉化為Fe(OH)3,因此在氯化鎂溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般將Fe2+先氧化成Fe3+,再調節溶液的pH=4,形成Fe(OH)3沉淀;
(1)Fe(OH)2的溶解度大于Fe(OH)3,上述三個除雜方案都能夠達到很好的效果,Fe2+、Fe3+都被轉化為Fe(OH)3而除去;
(2)除去鐵離子,可加入氨水,防止引入其它雜質;
(3)除去氯化鎂晶體中的雜質Fe3+,加入氫氧化鎂,可消耗酸,調節溶液pH,促進水解;
(4)A.根據H2O2是綠色氧化劑,在氧化過程中不引進雜質、不產生污染;
B.根據Fe(OH)2的溶解度大于Fe(OH)3,形成Fe(OH)2沉淀Fe2+沉淀不完全;
C.原來溶液是酸性較強,加入氫氧化銅或堿式碳酸銅可以與H+反應.H+反應后,PH增大,當PH=4的時候,Fe(OH)3完全沉淀,而Cu2+還沒沉淀,加入氫氧化銅或堿式碳酸銅是固體,不會引入新的雜質;
D.根據溶度積計算;
E.在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀.
解答 解:①中為了不引入其他雜質離子,應加氨水使Fe3+沉淀,而不能用氫氧化鈉溶液;
②中根據溶解度表可知Mg(OH)2易轉化為Fe(OH)3,因此在氯化鎂溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般將Fe2+先氧化成Fe3+,再調節溶液的pH=4,形成Fe(OH)3沉淀;
(1)由以上分析可知Fe3+、Fe2+ 都被轉化為Fe(OH)3沉淀,故答案為:Fe(OH)3;
(2)①中為了不引入其他雜質離子,應加氨水使Fe3+沉淀,而不能用氫氧化鈉溶液,故答案為:氨水;不會引入新的雜質;
(3)②中根據溶解度表可知Mg(OH)2易轉化為Fe(OH)3,發生Fe3+:2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s),
故答案為:2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s);
(4)A.H2O2是綠色氧化劑,還原產物為水,在氧化過程中不引進雜質、不產生污染,故A正確;
B.Fe(OH)2的溶解度大于Fe(OH)3,將Fe2+氧化為Fe3+的主要原因是防止沉淀不完全,故B錯誤;
C.原來溶液是酸性較強,加入氫氧化銅或堿式碳酸銅可以與H+反應.H+反應后,PH增大,當PH=4的時候,Fe(OH)3完全沉淀,而Cu2+還沒沉淀.而氫氧化銅或堿式碳酸銅是固體,不會引入新的雜質,故C正確;
D.由表中數據可知Cu(OH)2的溶解度為1.7×10-6g,則飽和溶液的c(OH-)=2c(Cu(OH)2)=$\frac{\frac{1.7×1{0}^{-6}g}{98g/mol}}{0.1L}×2$≈3.4×10-7mol/L>1×10-10mol/L,所以Cu2+可以大量存在于pH=4的溶液中,故D正確;
E.由表中數據可知Fe(OH)3的溶解度為3×10-9g,則飽和溶液的c(OH-)=3c(Fe(OH)3)=$\frac{\frac{3×1{0}^{-9}}{107g/mol}}{0.1L}×3$=3.0×10-10mol/L,則在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀,Fe3+一定不能大量存在,故E正確;
故選:ACDE.
點評 本題以難溶電解質的溶解平衡為載體綜合考查物質的分離、提純,為高頻考點,側重學生的分析、實驗能力的考查,注意把握鹽類水解的原理以及溶解平衡的理解和運用,難度中等.


科目:高中化學 來源: 題型:選擇題
 如圖:A處通入氯氣,關閉B閥時,C處干燥紅色布條無變化,打開B閥時,C處干燥的紅色布條褪色.則下列說法正確的是( )
如圖:A處通入氯氣,關閉B閥時,C處干燥紅色布條無變化,打開B閥時,C處干燥的紅色布條褪色.則下列說法正確的是( )| A. | D中可以盛放濃硫酸 | B. | D中可以盛放飽和食鹽水 | ||
| C. | D中可以盛放水 | D. | A處通入的是干燥的氯氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH═Na++O2-+H+ | B. | MgCl2═Mg2++Cl22- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NH4NO3═NH4++NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
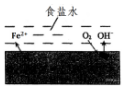 在一塊表面無銹的鐵片上滴食鹽水,放置一段時間后看到鐵片上有鐵銹出現.鐵片腐蝕過程中發生的總化學方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2進一步被氧氣氧化為Fe(OH)3,再在一定條件下脫水生成鐵銹,其原理如圖.下列說法正確的是( )
在一塊表面無銹的鐵片上滴食鹽水,放置一段時間后看到鐵片上有鐵銹出現.鐵片腐蝕過程中發生的總化學方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2進一步被氧氣氧化為Fe(OH)3,再在一定條件下脫水生成鐵銹,其原理如圖.下列說法正確的是( )| A. | 鐵片發生還原反應而被腐蝕 | |
| B. | 此過程中電子從C移向Fe | |
| C. | 鐵片腐蝕中負極發生的電極反應:2H2O+O2+4e-═4OH- | |
| D. | 鐵片里的鐵和碳與食鹽水形成無數微小原電池,發生了電化學腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙酰苯胺具有解熱鎮痛作用,是較早使用的解熱鎮痛藥,有“退熱冰”之稱,其制備原理如下:
乙酰苯胺具有解熱鎮痛作用,是較早使用的解熱鎮痛藥,有“退熱冰”之稱,其制備原理如下: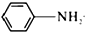 +CH3COOH$\stackrel{△}{?}$
+CH3COOH$\stackrel{△}{?}$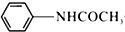 +H2O
+H2O| 物質 | 熔點 | 沸點 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于熱水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
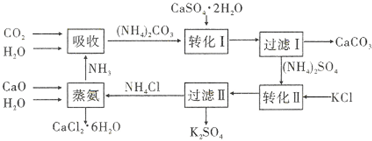
| 溫度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
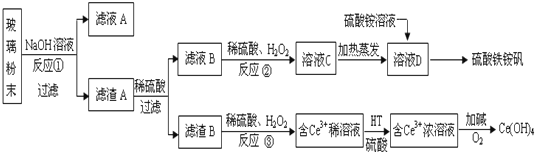
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com