

分析 氫氧化鉀溶液中充入足量氯氣,在溫度較低的條件下反應生成氯化鉀、次氯酸鉀和水,加入氫氧化鉀固體除去KCl,得到堿性KClO的濃溶液,加入90%硝酸鐵溶液發生反應生成高鐵酸鉀溶液Ⅱ純化得到濕產品,洗滌干燥得到K2FeO4晶體.
(1)根據n=$\frac{m}{M}$計算出氫氧化鉀的物質的量,溶液質量等于溶質質量與溶劑質量之和,利用V=$\frac{m}{ρ}$計算溶液體積,再根據c=$\frac{n}{V}$計算氫氧化鉀溶液的物質的量濃度;
(2)根據生產工藝流程圖,第①步氯氣過量,第③步需要堿性條件,在溫度較高時KOH 與Cl2 反應生成的是KClO3,氧化還原反應中化合價有升有降;
(3)據題目信息和氧化還原反應中化合價發生變化確定找出反應物:Fe3+、ClO-,生成物:FeO42-、Cl-,根據電子得失守恒和質量守恒來配平;
(4)釋放出一種具有氧化性的氣體單質是氧氣,根據氧化還原反應電子得失守恒配平.
解答 解:(1)61.6g KOH固體的物質的量為$\frac{61.6g}{56g/mol}$=1.1mol,溶液的質量為100mL×1g/mL+61.6g=161.6g,所以溶液的體積為$\frac{161.6g}{1.47×1{0}^{-3}g/L}$=$\frac{161.6}{1470}$L,所以氫氧化鉀溶液的物質的量濃度為$\frac{1.1mol}{\frac{161.6}{1470}L}$=10mol/L,
故答案為:10.0;
(2)由工藝流程可知,反應液I中有過量的Cl2反應,加KOH固體的目的是與過量的Cl2繼續反應,生成更多的KClO.
A、與過量的Cl2繼續反應,生成更多的KClO,故A正確;
B、由信息②可知溫度較高KOH與Cl2 反應生成的是KClO3,不利用KClO生成、浪費原料,故B錯誤;
C、由工藝流程及③可知,利用Fe(NO3)3與KClO制備K2FeO4,故C正確;
D、由信息可知,該條件下KClO3 不能轉化為KClO,故D錯誤;
故選:A、C;
(3)據題目信息和氧化還原反應中化合價發生變化確定找出反應物:Fe3+、ClO-,生成物:FeO42-、Cl-,根據電子得失守恒:Fe(+3→+6),Cl(+1→-1),最小公倍數為6,所以Fe3+、FeO42-前系數都為2,ClO-、Cl-,前系數都為3,結合質量守恒和電荷守恒可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案為:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)高鐵酸鉀(K2FeO4)與水反應時,生成紅褐色膠體的同時釋放出一種具有氧化性的氣體單質為氧氣,根據電子得失守恒和質量守恒來配平,可得4FeO42-+10H2O═4Fe(OH)3(膠體)+3O2↑+8OH-.
故答案為:4FeO42-+10H2O═4Fe(OH)3(膠體)+3O2↑+8OH-.
點評 本題結合高鐵酸鉀(K2FeO4)的制備主要考查了氧化還原反應的知識、離子方程式的書寫等,培養了學生運用知識的能力,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在H2O2+Cl2=2HCl+O2反應中,每生成32g氧氣,則轉移4NA個電子 | |
| B. | 含有NA個“Cu”微粒的CuO和Cu2S混合物質量為80g | |
| C. | 常溫常壓下,2.24L CO2和SO2混合氣中氧原子數為0.2NA | |
| D. | 100mL0.1mol/L的NaCl溶液中,所含微粒總數為0.02NA |
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三上學期月考一化學試卷(解析版) 題型:選擇題
在100℃時,將0.40mol二氧化氮氣體充入2L密閉容器中,每隔一段時間對該容器內的得到數據如下
時間(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列說法中正確的是
A.反應開始20s內以二氧化氮表示的平均反應速率為0.00125mol·L-1·s-
B.80s時混合氣體的顏色與60s時相同,比40s時的顏色深
C.80s時向容器中加入0.32mol氦氣,同時將容器擴大為4L,則平衡將不移動
D.若起始投料為0.20molN2O4,相同條件下達平衡,則各組分含量與原平衡體系對應相等
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上期中化學試卷(解析版) 題型:選擇題
1.52 g銅鎂合金完全溶解于50 mL密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀。下列說法不正確的是
A.該合金中銅與鎂的物質的量之比是2:1
B.該濃硝酸中HNO3的物質的量濃度是14.0 mol/L
C.NO2和N2O4的混合氣體中,NO2 的體積分數是80%
的體積分數是80%
D.得到2.54 g沉淀時,加入NaOH溶液的體積是600 mL
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上期中化學試卷(解析版) 題型:選擇題
設nA為阿伏加德羅常數的數值,下列說法正確的是
A.常溫常壓下,8 g O2含有4nA個電子
B.1 L 0.1 mol·L-1的氨水中有nA個NH
C.標準狀況下,22.4 L鹽酸含有nA個HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 高純MnCO3是制備高性能磁性材料的主要原料.實驗室以MnO2為原料制備少量高純MnCO3的操作步驟如下:
高純MnCO3是制備高性能磁性材料的主要原料.實驗室以MnO2為原料制備少量高純MnCO3的操作步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
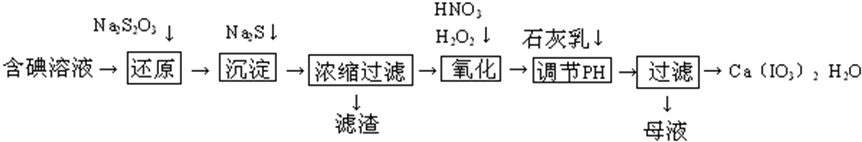
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
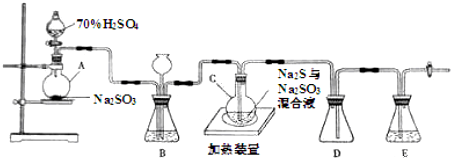
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com