
分析 (1)銅與濃硫酸在加熱條件下反應生成硫酸銅、二氧化硫氣體和水;由于只有濃硫酸才能和銅反應.而隨著反應的進行硫酸濃度變小,稀硫酸不與銅反應,所以有硫酸剩余;
(2)從反應的理論可行性,實際可操作性,經濟廉價性,環保安全性等方面進行考慮分析,對比甲乙反應過程分析可知,甲:濃硫酸直接核銅反應,會產生SO2,污染環境,且硫酸的用量也多,乙同學設計的制備過程,生成等量的硫酸銅消耗硫酸最少,反應過程中無二氧化硫污染氣體生成;
(3)銅和稀硫酸混合在加熱的條件下不斷通入空氣,反應生成硫酸銅與水.
解答 解:(1)在加熱條件下,銅與濃硫酸反應生成硫酸銅、二氧化硫氣體和水,反應方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,銅在金屬活動順序表中排在氫的后面,不與稀硫酸反應,由于只有濃硫酸才能和銅反應.而隨著反應的進行硫酸濃度變小,稀硫酸不與銅反應,所以燒瓶中還有較多的硫酸剩余,
故答案為:是;隨著反應的進行硫酸濃度變小,稀硫酸不與銅反應;Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)對比兩種設計方案:甲:Cu+2H2SO4(濃) $\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CuSO4+2H2O,
乙:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+H2SO4=CuSO4+H2O,可以看出制取等量的硫酸銅,乙方案消耗的硫酸少,并且產物中沒有有毒氣體,
故答案為:硫酸用量少,且沒有污染物SO2產生;
(3)銅和稀硫酸混合在加熱的條件下不斷通入空氣,反應生成硫酸銅與水,方程式為2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
故答案為:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
點評 本題通過利用廢銅制取CuSO4考查濃硫酸的化學性質和綠色化學,側重考查硫酸銅制備的方案評價,注意實驗方案設計應理論正確、操作簡單可行、經濟節約、綠色環保,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 摩爾是表示物質質量的單位 | |
| B. | 摩爾是國際七個基本物理量之一 | |
| C. | 用摩爾表示物質的量時,要用化學式指明粒子種類 | |
| D. | 摩爾既是物質的量的單位,又是粒子的數量單位 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
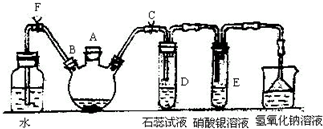 實驗室制備溴苯可用如圖所示的裝置,填寫下列空白:
實驗室制備溴苯可用如圖所示的裝置,填寫下列空白: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 儀 器 及 裝 置 圖 |  |  |  |  |  |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com