

| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |


分析 (1)在儀器A中灼燒海帶,該儀器為坩堝;配制溶液體積為500mL,應該選用規格為500mL的容量瓶;
(2)①根據表中數據繪制出滴定曲線;
②根據圖象判斷滴定終點時用去AgNO3溶液的體積;根據硝酸銀與碘離子的反應計算出100mL溶液中含有碘離子的物質的量,再計算出500mL溶液中含有的碘離子,最后計算出海帶中碘的百分含量;
(3)①檢查分液漏斗是否漏水,需要分別檢查瓶塞、旋塞是否漏水;
②碘單質易溶于有機溶劑,且四氯化碳溶液密度大于水溶液,檢查判斷萃取現象;
③A.反應3I2+6NaOH═5NaI+NaIO3+3H2O中,需要濃氫氧化鈉溶液;
B.碘單質與氫氧化鈉反應生成了碘化鈉、碘酸鈉;
C.該操作的主要目的是將碘單質轉化成碘酸鈉、碘化鈉,便于后續分離出碘單質;
D.乙醇易溶于水和四氯化碳,仍然無法分離出碘單質.
④碘單質不溶于水,可以通過過濾操作分離出碘單質;
(4)從碘單質易升華角度分析.
解答 解:(1)根據儀器的構造可知,用于灼燒海帶的儀器為坩堝;通過儀器B配制500mL含有碘離子的浸取液,需要使用500mL的容量瓶,
故答案為:坩堝;500mL容量瓶;
(2)①根據表中數據可以繪制出電動勢(E)與消耗硝酸銀溶液體積的關系圖為: ,
,
故答案為: ;
;
②根據滴定曲線可知,當加入20mL硝酸銀溶液時,電動勢出現了突變,說明滴定終點時消耗了20.00mL硝酸銀溶液;
20.00mL硝酸銀溶液中含有硝酸銀的物質的量為:0.0100mol/L×0.02L=0.0002mol,則500mL原浸出液完全反應消耗硝酸銀的物質的量為:0.0002mol×$\frac{500mL}{100mL}$=0.001mol,說明20.00g該海帶中含有0.001mol碘離子,所以海帶中碘的百分含量為:$\frac{127g/mol×0.001mol}{20.00g}$×100%=0.635%,
故答案為:20.00mL;0.635%;
(3)①檢查分液漏斗是否漏水的操作方法為:向分液漏斗中加入少量蒸餾水,檢查旋塞處是否漏水;將漏斗倒轉過來,檢查玻璃塞是否漏水,
故答案為:向分液漏斗中加入少量蒸餾水,檢查旋塞處是否漏水,將漏斗倒轉過來,檢查玻璃塞是否漏水;
②碘單質易溶于有機溶劑,微溶于水,且四氯化碳的密度大于水溶液,所以步驟X向含有碘單質的水溶液中加入四氯化碳后,混合液會分為上下兩層,下層為四氯化碳的碘溶液,則下層呈紫紅色,
故答案為:液體分為上下兩層,下層呈紫紅色;
③A.發生反應3I2+6NaOH═5NaI+NaIO3+3H2O中,需要濃氫氧化鈉溶液,所以應控制NaOH溶液的濃度和體積,故A正確;
B.根據反應3I2+6NaOH═5NaI+NaIO3+3H2O可知,步驟Y將碘轉化成離子進入水層,故B正確;
C.該操作的主要目的是將碘單質轉化成碘酸鈉、碘化鈉,將碘轉化成離子進入水層,不是除去有機雜質,故C錯誤;
D.乙醇易溶于水和四氯化碳,將氫氧化鈉換成乙醇,仍然無法分離出碘單質,故D錯誤;
故答案為:AB;
④步驟Z將碘單質和水分離,由于碘單質不溶于水,可通過過濾操作完成,故答案為:過濾;
(4)方案甲中采用蒸餾操作,由于碘單質容易升華,會導致碘單質損失,所以甲方案不合理,故答案為:碘單質易升華,會導致碘損失.
點評 本題考查物質的分離與提純方法的綜合應用,題目難度較大,試題涉及的知識點較多、綜合性較強,充分考查學生的分析、理解能力及化學實驗能力,明確實驗原理為解答關鍵,注意熟練掌握化學實驗基本操作方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 滴定管用蒸餾水洗滌后,裝入NaOH溶液進行滴定 | |
| B. | 隨著NaOH溶液滴入,錐形瓶中溶液pH由小變大 | |
| C. | 用酚酞作指示劑,當錐形瓶中溶液由紅色變無色時停止滴定 | |
| D. | 滴定終點時,發現滴定管尖嘴部分有懸滴,則測定結果偏小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
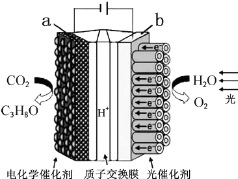
| A. | 該裝置將化學能轉化為光能和電能 | |
| B. | 該裝置工作時,H+從b極區向a極區遷移 | |
| C. | 每生成1mol O2,有44g CO2被還原 | |
| D. | a電極的反應為:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
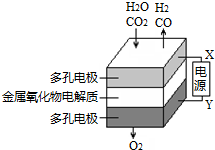 在固態金屬氧化物電解池中,高溫共電解H2O-CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示.下列說法不正確的是( )
在固態金屬氧化物電解池中,高溫共電解H2O-CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示.下列說法不正確的是( )| A. | X是電源的負極 | |
| B. | 陰極的反應式是:H2O+2e-═H2+O2-,CO2+2e-═CO+O2- | |
| C. | 總反應可表示為:H2O+CO2$\frac{\underline{\;通電\;}}{\;}$H2+CO+O2 | |
| D. | 陰、陽兩極生成的氣體的物質的量之比是1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 操作及現象 | 結論 | |
| A | 向AgCl懸濁液中加入NaI溶液時出現黃色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈紅色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振蕩、靜置,溶液上層呈橙紅色 | Br-還原性強于Cl- |
| D | 加熱盛有NH4Cl固體的試管,試管底部固體消失,試管口有晶體凝結 | NH4Cl固體可以升華 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 2s22p3和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p3 | D. | 3s23p1和3s23p4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3H6、CH2═CHCH3 | B. | H2O2、 | C. |  | D. |  1S22S22p63S23p6 1S22S22p63S23p6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 若A是可溶性強堿,B是正鹽,D不溶于稀硝酸,則B的化學式為(NH4)2SO4 | |
| B. | 若A和B都是鹽,A難溶于水,而B易溶于水,D不溶于稀硝酸,C為無色無味氣體,則B的化學式為NaHSO4 | |
| C. | 若A是2:1 型的離子化合物,B是硫酸鹽,D既可溶于稀鹽酸又可溶于NaOH溶液,且A與B的物質的量之比為3:1時恰好完全反應,則B的化學式為Al2(SO4)3 | |
| D. | 若A是1:1型的離子化合物,A與過量的B溶液反應才有D生成;將C燃燒的產物通過裝有堿石灰的干燥管或盛有濃硫酸的洗氣瓶,兩者的質量都增加,則B的化學式一定為Al2(SO4)3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com