
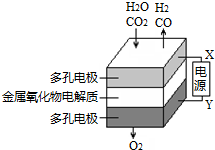
 在固態(tài)金屬氧化物電解池中,高溫共電解H2O-CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示.下列說(shuō)法不正確的是( )
在固態(tài)金屬氧化物電解池中,高溫共電解H2O-CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示.下列說(shuō)法不正確的是( )| A. | X是電源的負(fù)極 | |
| B. | 陰極的反應(yīng)式是:H2O+2e-═H2+O2-,CO2+2e-═CO+O2- | |
| C. | 總反應(yīng)可表示為:H2O+CO2$\frac{\underline{\;通電\;}}{\;}$H2+CO+O2 | |
| D. | 陰、陽(yáng)兩極生成的氣體的物質(zhì)的量之比是1:1 |
分析 A.電解池陽(yáng)極發(fā)生氧化反應(yīng),陰極發(fā)生還原反應(yīng),根據(jù)與X極相連的電極產(chǎn)生的氣體判斷;
B.電解池陰極發(fā)生還原反應(yīng),根據(jù)反應(yīng)物結(jié)合化合價(jià)的變化分析;
C.根據(jù)圖示以及電解的目的解答;
D.根據(jù)圖示知:陰極產(chǎn)生H2、CO,陽(yáng)極產(chǎn)生氧氣,結(jié)合C總的反應(yīng)分析;
解答 解:A.根據(jù)圖示知:與X相連的電極產(chǎn)生CO,電解H2O-CO2混合氣體,二氧化碳得到電子生成一氧化碳,發(fā)生還原反應(yīng),電解池陰極發(fā)生還原反應(yīng),所以X是電源的負(fù)極,故A正確;
B.電解池陰極發(fā)生還原反應(yīng),電解H2O-CO2混合氣體制備H2和CO,陰極:水中的氫原子得到電子生成氫氣,H2O+2e-═H2↑+O2-,二氧化碳得到電子生成一氧化碳,CO2+2e-═CO+O2-,故B正確;
C.電解H2O-CO2混合氣體制備H2和CO,根據(jù)圖示知:陰極產(chǎn)生H2、CO,陽(yáng)極產(chǎn)生氧氣,所以總反應(yīng)為:H2O+CO2$\frac{\underline{\;通電\;}}{\;}$H2+CO+O2,故C正確;
D.電解H2O-CO2混合氣體制備H2和CO,總反應(yīng)為:H2O+CO2$\frac{\underline{\;通電\;}}{\;}$H2+CO+O2,陰極產(chǎn)生H2、CO,陽(yáng)極產(chǎn)生氧氣,陰、陽(yáng)兩極生成的氣體的物質(zhì)的量之比是2:1,故D錯(cuò)誤;
故選D.
點(diǎn)評(píng) 本題考查電解知識(shí),為高頻考點(diǎn),側(cè)重于考查學(xué)生的綜合運(yùn)用能力,題目難度中等,注意基礎(chǔ)知識(shí)的積累掌握,掌握電解池陽(yáng)極發(fā)生氧化反應(yīng),陰極發(fā)生還原反應(yīng)為解答關(guān)鍵.



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:解答題
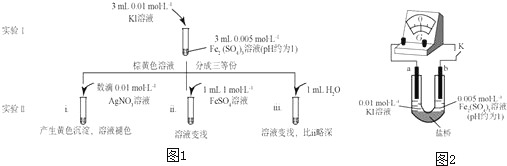
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題

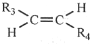 ,則T的結(jié)構(gòu)簡(jiǎn)式為
,則T的結(jié)構(gòu)簡(jiǎn)式為 .
.查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
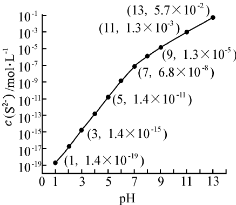
 .
.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題

| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |


查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
 合金貯氫材料具有優(yōu)異的吸放氫性能,在配合氫能的開發(fā)中起到重要作用.
合金貯氫材料具有優(yōu)異的吸放氫性能,在配合氫能的開發(fā)中起到重要作用.查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題

查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 原子半徑:Y>Z>R>T | |
| B. | 氣態(tài)氫化物的穩(wěn)定性:W<R<T | |
| C. | 最高價(jià)氧化物對(duì)應(yīng)的水化物的堿性:X>Z | |
| D. | XR2、WR2兩種化合物中R的化合價(jià)相同 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com