
| 實驗 編號 | T(℃) | NO初始濃度 (mol•L-1) | CO初始濃度 (mol•L-1) | 催化劑的比表 面積(m2•g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平 衡常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
分析 (1)①根據實驗目的驗證溫度、催化劑比表面積對化學反應速率的影響規律,則應保證濃度相同,然后相同溫度時比較催化劑比表面積,相同催化劑比、表面積時比較溫度;
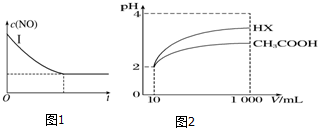
②利用影響化學反應速率及化學平衡的因素來分析圖象;
(2)依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式;
(3)①電離平衡常數越大,酸的電離程度越大,溶液酸性越強;
②由圖可知,稀釋相同的倍數,HX的pH變化程度大,則酸性HX強,電離平衡常數大;
(4)①硫酸電離出的氫離子抑制了水的電離,硫酸溶液中的氫氧根離子是水電離的,據此計算出溶液水電離的氫離子和氫氧根離子濃度;
②0.01mol/L的NaOH溶液的pH為11,則c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,根據Kw=c(H+)×c(OH-)計算水的離子積,若所得混合溶液為中性,且a=2,b=12,根據c(OH-)×Vb=c(H+)×Va計算Va:Vb.
解答 解:(1)①因Ⅰ、Ⅱ比表面積不同,則應控制溫度相同,所有濃度應控制相同來驗證催化劑比表面積對速率的影響;
I、Ⅲ比表面積相同,溫度不同,則所有濃度應控制相同來驗證反應溫度對速率的影響,
故答案為:
| 實驗 編號 | t(℃) | NO初始濃度 (mol/L) | CO初始濃度 (mol/L) | 催化劑的 比表面積(m2/g) |
| Ⅰ | ||||
| Ⅱ | 280 | 5.80×10-3 | ||
| Ⅲ | 1.20×10-3 | 5.80×10-3 |
 ,
, ;
;點評 本題考查較為綜合,涉及酸堿混合的定性判斷及溶液pH的計算、熱化學方程式的計算、化學反應速率的影響因素等知識,題目難度中等,明確溶液酸堿性與溶液pH的關系為解答關鍵,注意掌握影響化學反應速率的因素,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力及靈活應用能力.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:解答題
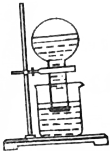 甲同學按如圖所示裝置做新制氯水受日光照射分解放出O2的驗證實驗,結果現象不明顯.
甲同學按如圖所示裝置做新制氯水受日光照射分解放出O2的驗證實驗,結果現象不明顯.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 漂白粉是混合物,漂粉精是純凈物 | |
| B. | 工業上將氯氣通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
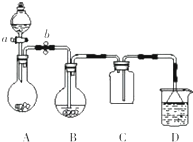 某化學小組設計了如圖所示裝置.用以探究Cu跟濃H2SO4的反應并收集少量氣態產物(加熱及夾持裝置省略).
某化學小組設計了如圖所示裝置.用以探究Cu跟濃H2SO4的反應并收集少量氣態產物(加熱及夾持裝置省略).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 玻璃棒 | B. | 膠頭滴管 | C. | 托盤天平 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲醇[CH3OH] | B. | 氯化鈣[CaCl2] | C. | 尿素[CO(NH2)2] | D. | 亞硝酸鈉[NaNO2] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 (“→”表示一步完成)關系相互轉化的是( )
(“→”表示一步完成)關系相互轉化的是( )| 選項 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | MgO | MgCl2 | Mg(OH)2 |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | Na2CO3 | Na2SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com