
【題目】雙極膜(BP)是陰、陽復合膜,在直流電的作用下,陰、陽膜復合層間的H2O解離成H+和OH-,作為H+和OH-離子源。利用雙極膜電滲析法電解食鹽水可獲得淡水、NaOH和HC1,其工作原理如下圖所示,M、N為離子交換膜。

下列說法錯誤的是
A. 陰極室發生的反應為2H++2e-=H2↑
B. M為陽離子交換膜,N為陰離子交換膜
C. 若去掉雙極膜(BP),陽極室會有C12生成
D. 電路中每轉移1mol電子,兩極共得到0.5 mol氣體
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列有關電池的說法不正確的是( )
A.燃料電池屬于二次電池
B.銅鋅原電池工作時,電流沿外電路從銅電極流向鋅電極
C.甲醇燃料電池可把化學能轉化為電能
D.鋅錳干電池中,鋅電極是負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】4P(紅磷s) ![]() P4(白磷s);△H=+17kJ·mol-1根據以上方程式,下列推論正確的是
P4(白磷s);△H=+17kJ·mol-1根據以上方程式,下列推論正確的是
A.當lmol白磷轉變成紅磷時放出17kJ熱量
B.當4g紅磷轉變成白磷時吸收17kJ熱量
C.正反應是一個放熱反應
D.白磷熱穩定性比紅磷大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25 ℃ 時,0.1 mo1·L-1某一元酸HA在水中有0.1%發生電離,下列敘述正確的是
A. 該溶液的pH=3
B. 升高溫度,溶液的pH增大
C. 此酸的電離方程式為HA=H+ + A-
D. 由HA電離出的c(H+)約為水電離出的c(H+)的106倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:pKa=-lgKa,25℃時,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲線如下圖所示(曲線上的數字為pH)。下列說法正確的是
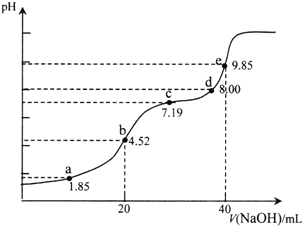
A. a點所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b點所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c點所得溶液中:c(Na+)>3c(HSO3-)
D. e點所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備乙酸乙酯的裝置,如圖所示,回答下列問題:

(1)乙醇、乙酸和濃硫酸混合順序應為_____________________。
(2)收集乙酸乙酯的試管內盛有的飽和碳酸鈉溶液的作用是____________________。
(3)反應中濃硫酸的作用________________________________。
(4)反應中乙醇和乙酸的轉化率不能達到100%,原因是_______________________。
(5)收集在試管內的乙酸乙酯是在碳酸鈉溶液的________層。
(6)該反應的化學方程式為______________________。
(7)將收集到的乙酸乙酯分離出來的方法為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種三室微生物燃料電池污水凈化系統原理如圖所示,其中離子交換膜I、II分別是氯離子交換膜和鈉離子交換膜中的一種,圖中有機廢水中的有機物可用C6H10O5表示。下列有關說法正確的是

A. a電極為該電池的負極,離子交換膜I是鈉離子交換膜
B. a電極附近溶液的氯離子濃度增大,b電極附近溶液的pH減小
C. a電極的電極反應式為C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中間室中Na+移向左室,Cl—移向右室
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】位于短周期的四種主族元素A、B、C、D,原子序數依次增大,已知A、C位于同一主族,A在周期表中原子半徑最小。B、D的最外層電子數相等,且B、D的原子序數之和為A、C原子序數之和的兩倍。E是自然界中含量最高的金屬。根據你的推斷完成下列問題:
(1)B元素的名稱為_______,E的元素符號為_______。
(2)寫出由上述元素形成的具有漂白作用的三種物質的化學式______,______,_____。
(3)用電子式表示C與D形成化合物的過程_______。
(4)寫出E的最高價氧化物與強堿反應的離子方程式________。
(5)B、C兩元素形成的原子個數比為1∶1的化合物中的化學鍵為_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com