
| 實驗操作 | 預期現象與結論 |
| 步驟1: | 有白色沉淀生成,證明待測液中含SO42- |
| 步驟2: | 溶液呈橙黃色,證明待測液中含Br- |
分析 (1)長期攝入過量的亞硫酸鹽,紅細胞和血紅蛋白會減少,鈣的吸收也會減少是因為亞硫酸根離子結合亞鐵離子、鈣離子形成沉淀;
(2)檢驗某黑木耳中是否含有亞硫酸鹽的簡單方法是將黑木耳樣品剪成碎末放入燒杯,加入20mL水和10mL鹽酸,加熱一會兒,加熱是加快亞硫酸鹽溶解,加熱過程生成的亞硫酸會分解;
(3)將黑木耳樣品剪成碎末放入燒杯,加入20mL水和10mL鹽酸,加熱一會兒,滴入試劑A,是檢驗亞硫酸的存在,加入品紅溶液會和亞硫酸結合生成無色不穩定的化合物;
(4)在足量的亞硫酸鈉溶液中加入1~2滴液溴,振蕩后溶液變為無色是溴單質和二氧化硫發生氧化還原反應生成亞硫酸氫鹽、硫酸和溴化鈉;
(5)溶液中含有SO32-、HSO3-、SO42-、Br-、OH-等陰離子.設計實驗檢驗SO42-和Br-,硫酸根離子檢驗是取少量溶液加入過量鹽酸,排除其它離子干擾,加入氯化鋇溶液生成白色沉淀證明;溴離子的檢驗方法是利用少量溶液中加入過量氯水氧化溴離子為溴單質,溶液呈橙黃色證明.
解答 解:(1)亞硫酸鹽具有一定的毒性,長期攝入過量的亞硫酸鹽,紅細胞和血紅蛋白會減少,鈣的吸收也會減少,是因為亞硫酸根離子結合亞鐵離子、鈣離子形成沉淀,
故答案為:SO32-與Fe2+、Ca2+結合形成沉淀;
(2)檢驗某黑木耳中是否含有亞硫酸鹽的簡單方法是:將黑木耳樣品剪成碎末放入燒杯,加入20mL水和10mL鹽酸,溶解反應生成亞硫酸,加熱一會兒促進黑木耳中的亞硫酸鹽全部溶解,是加快亞硫酸鈉溶解,加熱時間不能太長,因為加熱過程會導致生成的亞硫酸會分解,無法檢驗亞硫酸的存在,
故答案為:加快亞硫酸鈉的溶解,防止亞硫酸受熱分解成二氧化硫逸出;
(3)將黑木耳樣品剪成碎末放入燒杯,加入20mL水和10mL鹽酸,加熱一會兒,滴入試劑A,是檢驗亞硫酸的存在,所以加入品紅溶液會和亞硫酸結合生成無色不穩定的化合物,
故答案為:品紅溶液;
(4)在足量的亞硫酸鈉溶液中加入1~2滴液溴,振蕩后溶液變為無色,是溴單質和二氧化硫發生氧化還原反應,溴單質少反應生成亞硫酸氫鈉、硫酸和溴化鈉,反應的離子方程式為:3SO32-+Br2+H2O=2HSO3-+SO42-+2Br-,
故答案為:3SO32-+Br2+H2O=2HSO3-+SO42-+2Br-;
(5)溶液中含有SO32-、HSO3-、SO42-、Br-、OH-等陰離子.設計實驗檢驗SO42-和Br-,硫酸根離子檢驗是取少量溶液加入過量鹽酸,排除SO32-、HSO3-等離子干擾,加入氯化鋇溶液生成白色沉淀證明待測液中含SO42-;溴離子的檢驗方法是:取少量待測液放入試管,加入過量氯水,氯氣氧化溴離子為溴單質,溶液呈橙黃色證明待測液中含Br-,
故答案為:
| 實驗操作 | 預期現象與結論 |
| 步驟1:取少量待測液放入試管,加入過量鹽酸,加入氯化鋇溶液 | 有白色沉淀生成,證明待測液中含SO42- |
| 步驟2:取少量待測液放入試管,加入過量氯水 | 溶液呈橙黃色,證明待測液中含Br- |
點評 本題考查了物質的組成和成分的檢驗,主要是離子的性質和反應的特征現象分析,掌握實驗基礎和物質性質是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
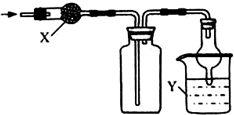
| 選項 | X | 收集氣體 | Y |
| A | 堿石灰 | 氯化氫 | 水 |
| B | 堿石灰 | 氨氣 | 水 |
| C | 無水氯化鈣 | 二氧化硫 | 氫氧化鈉 |
| D | 無水氯化鈣 | 一氧化氮 | 氫氧化鈉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
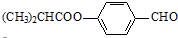 .合成M的一種途徑如下
.合成M的一種途徑如下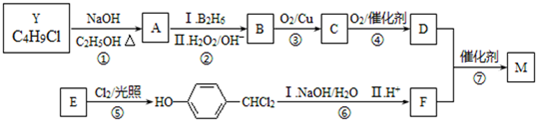
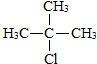 .
.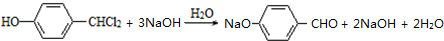 .
. .
.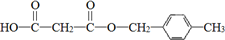 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  用裝置制取氯氣 | |
| B. | 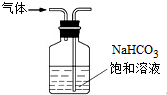 用裝置除去氯氣中混有的少量氯化氫 | |
| C. | 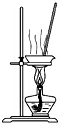 用裝置蒸干氯化錳溶液制MnCl2•4H2O | |
| D. | 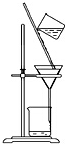 用裝置分離二氧化錳和氯化錳溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用濾紙稱量NaOH固體 | |
| B. | 移液前容量瓶內有水珠 | |
| C. | 搖勻后,液面低于刻度線,再加水至刻度線 | |
| D. | 定容時,俯視刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液和Al2(SO4)3溶液分別加熱蒸發,所得固體的成分相同 | |
| B. | 配制FeCl3溶液時,將FeCl3固體溶解在鹽酸中,然后再用水稀釋到所需的濃度 | |
| C. | 中和熱測定時,用銅制攪拌器代替玻璃環形攪拌器,測定的實驗結果不變 | |
| D. | 室溫時將Na2CO3溶液加水稀釋后,再恢復至室溫,pH和KW均減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醋酸鈉溶液的PH 大于7 | |
| B. | 常溫時,0.1mol/L乙酸溶液的PH約為3 | |
| C. | 乙酸能和碳酸鈣反應放出CO2 | |
| D. | PH=1的醋酸溶液用水稀釋1000倍后,pH<4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 微粒 | X | Y | Na+ | A- |
| 濃度/(mol•L-1) | 8.00×10-4 | 2.50×10-10 | 0.100 | 9.92×10-2 |
| A. | 0.1mol•L-1HA溶液的pH=1 | B. | 該溫度下Kw=1.0×10-14 | ||
| C. | 微粒X表示OH-,Y表示H+ | D. | 混合溶液中:n(A-)+n(X)=n(Na+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com