
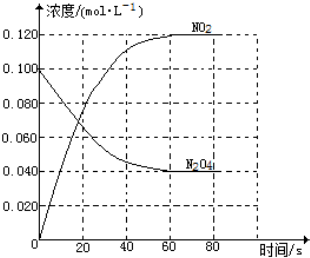
 在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度的升高,混合氣體的顏色變深.
在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度的升高,混合氣體的顏色變深.分析 (1)隨溫度的升高,混合氣體的顏色變深,平衡向正反應方向移動,據此判斷反應熱;根據v=$\frac{△c}{△t}$計算在0~60s時段反應速率v(NO2);根據轉化率=$\frac{反應消耗的濃度}{初始濃度}$×100%計算達到平衡時N2O4的轉化率;
(2)①N2O4的濃度降低,平衡向正反應方向移動,由于正反應方向吸熱,T>100℃;
②計算出T℃時N2O4、NO2的濃度,然后根據平衡常數的表達式計算出該溫度下該反應的平衡常數.
解答 解:(1)隨溫度的升高,混合氣體的顏色變深,化學平衡向正反應方向移動,即△H>0;
0~60s時段,NO2濃度變化為:0.12mol/L,v(NO2)=$\frac{0.12mol/L}{60s}$=0.002mol•L-1•s-1;
平衡時N2O4的濃度為0.040mol/L,則N2O4的轉化率為:$\frac{0.10-0.04}{0.1}$×100%=60%,
故答案為:>;0.002;60%;
(2)①100℃時達平衡后,改變反應溫度為T,c(NO2)以0.0040mol•L-1•s-1的平均速率增加,升高溫度后平衡向正反應方向移動,由于正反應方向吸熱,T>100℃,
故答案為:>;c(NO2)增大平衡正向移動,正反應為吸熱反應,故溫度升高;
②平衡時,c(NO2)=0.120mol•L-1+0.0040mol•L-1•s-1×10s=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0040mol•L-1•s-1×$\frac{1}{2}$×10s=0.020mol•L-1,
則溫度T時反應的平衡常數為:K=$\frac{(0.016)^{2}}{0.020}$=1.28,
故答案為:1.28.
點評 本題考查了化學平衡常數的計算,題目難度中等,明確圖象曲線變化的含義為解答關鍵,注意掌握化學反應速率、化學平衡常數的概念及表達式,明確化學平衡及其影響為解答關鍵,試題培養了學生的分析能力及化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | NaCl溶液 | B. | NaOH溶液 | C. | NaHCO3溶液 | D. | NaHSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50mL 1mol•L-1 FeCl3溶液 | B. | 25mL 2mol•L-1 CaCl2溶液 | ||
| C. | 50mL 2mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通入足量氨氣:NH4+、SO42-、OH-、AlO2- | |
| B. | 加入足量Na2O2:Na+、Fe2+、SO42-、OH- | |
| C. | 加入過量稀硝酸:Al3+、Fe3+、H+、NO3-、SO42- | |
| D. | 加入過量漂白粉溶液:Ca2+、Fe2+、Cl-、ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Na+、HSO3-、Cl- | B. | Na+、Ba2+、NO3-、Cl- | ||
| C. | K+、S2-、Cl-、CO32- | D. | K+、NH4+、Cl-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com