
| A. | NaCl溶液 | B. | NaOH溶液 | C. | NaHCO3溶液 | D. | NaHSO4溶液 |
分析 弱電解質的電離和鹽類水解都是吸熱反應,升高溫度促進弱電解質電離和鹽類水解,導致溶液中水的離子積常數增大,根據溶液中氫離子濃度變化來確定pH變化.
解答 解:A、氯化鈉是強電解質,在水溶液里完全電離,升高溫度促進水的電離,Kw會升高,氫離子的濃度變大,pH減小,故A錯誤;
B、升高溫度時NaOH溶液中氫氧根離子的濃度不變,但升高溫度時水的離子積變大,則氫離子的濃度變大,故溶液的pH變小,故B錯誤;
C、NaHCO3是強堿弱酸鹽,在溶液中能水解顯堿性,而升高溫度時,水解被促進,故溶液中的氫氧根的濃度增大,故pH會發生變化,故C錯誤;
D、NaHSO4在溶液中完全電離為鈉離子、氫離子和硫酸根,故0.1mol/L的溶液NaHSO4中氫離子濃度為0.1mol/L,當加熱時氫離子濃度不變,則pH不變,故D正確.
故選D.
點評 本題考查了pH的簡單計算,明確溫度對弱電解質的電離、鹽類水解的影響是解本題關鍵,注意A和D選項的比較,升高溫度導致水的離子積常數增大,根據溶液中氫離子濃度變化來判斷即可,難度中等.


 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案科目:高中化學 來源: 題型:多選題
| 操作和現象(或數據) | 結論 | |
| A | 向盛有1 mL 0.1 mol/L MgCl2溶液試管中加1 mL 0.2 mol/L NaOH溶液,有白色沉淀生成,再加入2滴0.1mol/LFeCl3溶液,又生成紅褐色沉淀 | 溫度相同時,Fe(OH)3溶解度小于Mg(OH)2 |
| B | 向含有少量氫氧化鎂沉淀的試管中滴入NH4Cl溶液,沉淀逐漸溶解,并有刺激性的氣味氣體產生 | 對應的離子反應方程式為NH4++OH-═NH3↑+H2O- |
| C | 20克Ba(OH)2•8H2O粉末和10克NH4Cl粉末混合后玻璃棒迅速攪拌,可以聞到刺激性氣味的氣體 | 該反應為放熱反應,促使氨水分解生成NH3 |
| D | 常溫下,將NaAlO2溶液和NaHCO3溶液混合產生大量白色沉淀 | 說明AlO2-結合H+能力大于CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
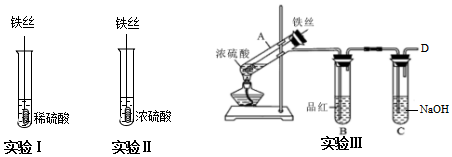
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol碳正離子(CH3+)所含質子總數為8NA | |
| B. | 常溫常壓下,46gNO2和N2O4混和氣體中含原子總數為3NA | |
| C. | 標準狀況下,11.2L氟化氫中含有氟原子的數目為0.5NA | |
| D. | 14g14C原子形成的石墨中,所含C-C健的個數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
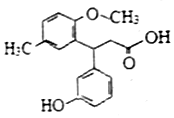
| A. | 所有碳原子可以共平面 | B. | 分子中有1個手性碳原子 | ||
| C. | 能與Na2CO3溶液反應 | D. | 能發生加成、取代、消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 摩爾是聯系宏觀和微觀的物理量 | |
| B. | Na的摩爾質量為23g/mol | |
| C. | 非標準狀況下氣體摩爾體積不可能為22.4 L | |
| D. | 1mol氫的質量為2g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
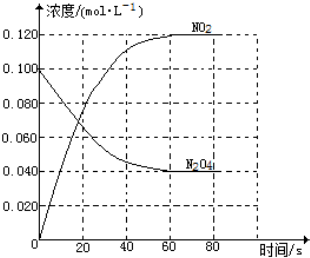 在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度的升高,混合氣體的顏色變深.
在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度的升高,混合氣體的顏色變深.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com