
| A. | 鉛蓄電池放電過程中,正極質量增加,負極質量減小 | |
| B. | 將0.1 mol•L-1的NH3•H2O溶液加水稀釋,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值減小 | |
| C. | NaHCO3溶于水,溶液中存在電離平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,該反應在任意溫度下都能自發進行 |
分析 A、根據鉛蓄電池的工作原理來回答;
B、加水稀釋促進電離,銨根離子濃度增大,一水合氨濃度減小,所以$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值增大;
C、碳酸氫根離子是弱離子在水溶液里存在水解平衡和電離平衡;
D、碳酸鈣分解屬于吸熱反應,△H>0,CaCO3(s)═CaO(s)+CO2(g),固體分解得到氣體,混亂度增加,△S>0,根據△G=△H-T•△S<0自發判斷.
解答 解:A、鉛蓄電池工作時,負極是金屬鉛失電子,正極上是二氧化鉛得電子,都是生成硫酸鉛,質量增加,故A錯誤;
B、加水稀釋促進電離,銨根離子濃度增大,一水合氨濃度減小,所以$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值增大,故B錯誤;
C、碳酸氫根離子是多元弱酸的酸式根離子,弱離子在水溶液里存在水解平衡和電離平衡,故C正確;
D、碳酸鈣分解屬于吸熱反應,△H>0,CaCO3(s)═CaO(s)+CO2(g),固體分解得到氣體,混亂度增加,△S>0,在高溫條件下△G=△H-T•△S<0反應自發進行,低溫時不自發,故D錯誤;
故選C.
點評 本題綜合考查學生原電池和電解池的工作原理知識、化學反應進行的方向,能夠根據化學方程式準確判斷出焓變和熵變,然后根據△G=△H-T•△S<0自發判斷溫度即可.


科目:高中化學 來源: 題型:選擇題
| A. | 五種元素的原子半徑從大到小的順序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有極性共價鍵和非極性共價鍵 | |
| C. | 用M單質作陽極,石墨電極作陰極電解NaHCO3溶液,電解一段時后,在陰極區會出現白色沉淀 | |
| D. | X、Z兩元素能形成原子個數比(X:Z)為3:1和2:1的化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,②
,② 中氯原子較難水解.
中氯原子較難水解. 或
或 .
. .
.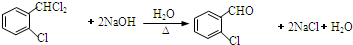 .
. .
. .
. ,寫出由乙烯、甲醇為有機原料制備化合物
,寫出由乙烯、甲醇為有機原料制備化合物 的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氣與氯氣反應后,體系的能量降低 | |
| B. | 需要加熱才能發生的反應一定是吸熱反應 | |
| C. | 若生成物的總能量高于反應物的總能量,則反應過程吸收能量 | |
| D. | 化學反應的實質是舊化學鍵的斷裂和新化學鍵的形成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將廢電池深埋,可防止重金屬污染 | |
| B. | 所有自發進行的化學反應都是放熱反應 | |
| C. | 開發太陽能、風能和氫能等能源代替化石燃料,有利于節約資源、保護環境 | |
| D. | 開發利用可燃冰是緩解能源緊缺的唯一途徑 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 在2L的恒容密閉容器中,發生反應:A(g)+B(g)?2C(g)+D(s)△H=-a kJ•mol-1,實驗內容和結果分別如表和如圖所示.下列說法正確的是( )
在2L的恒容密閉容器中,發生反應:A(g)+B(g)?2C(g)+D(s)△H=-a kJ•mol-1,實驗內容和結果分別如表和如圖所示.下列說法正確的是( )| 實驗 序號 | 溫度 | 起始物質的量 | 熱量 變化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5mol | -- |
| A. | 實驗Ⅰ中,10 min內平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 600℃時,上述方程式中a=160 | |
| C. | 600℃時,該反應的平衡常數是0.45 | |
| D. | 向實驗Ⅱ的平衡體系中再充入0.5 mol A和1.5 mol B,A的轉化率不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常溫下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含1.2 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 減少炭的量 | B. | 保持體積不變,增加水蒸氣的量 | ||
| C. | 將容器體積縮小一半 | D. | 保持壓強不變,充入Ne |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com