

 ,屬于弱電解質的是H2O、Al(OH)3.
,屬于弱電解質的是H2O、Al(OH)3.分析 (1)鋁元素基態原子的電子排布式為:1s22s22p63s23p1,原子核外共有5種能級的電子,共占據7個軌道;
(2)根據通過加熱引發鋁熱反應以及鋁熱反應為放熱反應以及溫度升高化學反應速率加快;
(3)①鋁-氧電池正極上是氧氣得電子的還原反應;
②根據電池的總反應判斷電解質pH的變化;
(4)二氧化碳分子中含有兩個碳氧雙鍵,碳原子最外層為8個電子;弱酸、弱堿以及水屬于弱電解質;
(5)電解過程中生成的氧氣全部與石墨電極反應生成C0和C02氣體;
(6)根據碳熱還原氯化法從鋁土礦中煉鋁的步驟來進行即可.
解答 解:(1)鋁元素基態原子的電子排布式為:1s22s22p63s23p1,原子核外共有5種能級的電子,共占據7個軌道,故答案為:5;7;
(2)因通過加熱引發鋁熱反應,所以開始速率為零,一旦反應,反應放熱,溫度不斷升高,化學反應速率加快,故選:b;
(3)①鋁-氧電池正極上是氧氣得電子的還原反應:O2+4e-+2H2O=4OH-;故答案為:O2+4e-+2H2O=4OH-;
②鋁-氧電池在使用過程中,負極反應為Al+4OH-═[Al(OH)4]-+3e-,正極上是氧氣得電子的還原反應:O2+4e-+2H2O=4OH-,總反應是:4OH-+4Al+3O2+6H2O═4[Al(OH)4]-,電解質溶液的pH減小,故答案為:減小;
(4)二氧化碳為直線型結構,屬于非極性分子,分子中存在兩個碳氧雙鍵,二氧化碳的電子式為 ,弱堿Al(OH)3、水屬于弱電解質;故答案為:
,弱堿Al(OH)3、水屬于弱電解質;故答案為: ;H2O、Al(OH)3;
;H2O、Al(OH)3;
(5)工業上采用石墨為電極點解氧化鋁的方法制備金屬鋁,電解過程中生成的氧氣全部與石墨電極反應生成C0和C02氣體,因此,需要不斷補充石墨電極,故答案為:
電解過程中生成的氧氣全部與石墨電極反應,消耗石墨電極;
(6)根據發生的反應:Al2O3(s)+AlCl3(g)+3C(s)$\stackrel{高溫}{→}$3AlCl(g)+3CO(g)、3AlCl(g)$\stackrel{低溫}{→}$2Al(l)+AlCl3(g),得到碳熱還原氯化法煉鋁的操作步驟:將Al2O3與焦炭的混合物加入高溫反應容器中,通入AlCl3氣體,使得第一步反應開始發生;將生成的AlCl通入到低溫反應容器中,發生第二步反應;最后分離出鋁,并將AlCl3(g)通入到高溫反應容器中繼續參與第一步反應,循環使用,
故答案為:將生成的AlCl通入到低溫反應容器中;分離出鋁,并將AlCl3(g)通入到高溫反應容器中循環使用.
點評 本題涉及原電池和電解池的工作原理知識一斤基本概念的考查,注意知識的歸納和梳理是解題的關鍵,難度中等.


科目:高中化學 來源: 題型:選擇題
| 選項 | A | B | C | D |
| 實驗方案 | 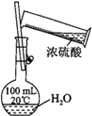 | 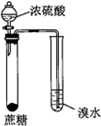 | 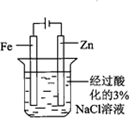 | 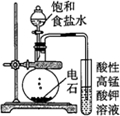 |
| 實驗目的 | 配制一定物質的量濃度的硫酸 | 驗證濃硫酸具有脫水性、氧化性 | 驗證Fe電極被保護 | 用該裝置制備并檢驗乙炔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,打開分液漏斗后,加熱,燒杯中出現黃色沉淀并有臭雞蛋氣味的氣體逸出,則原燒杯中n(Na2S)與n(Na2SO3)的比值需滿足( )
如圖所示,打開分液漏斗后,加熱,燒杯中出現黃色沉淀并有臭雞蛋氣味的氣體逸出,則原燒杯中n(Na2S)與n(Na2SO3)的比值需滿足( )| A. | >2 | B. | <2 | C. | =2 | D. | 1~2之間 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 異胡薄荷醇遇FeCl3溶液顯紫色 | |
| B. | 每個青蒿素分子中含有4個六元環 | |
| C. | 異胡薄荷醇可發生消去反應、加成反應 | |
| D. | 青蒿素在熱的酸、堿溶液中均可穩定存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO- | |
| B. | 滴入酚酞顯紅色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 含有Fe3+的溶液中:Na+、Al3+、Cl-、SCN- | |
| D. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、OH-、S2O${\;}_{3}^{2-}$、Cl- | B. | Fe2+、K+、H+、NO${\;}_{3}^{-}$ | ||
| C. | H+、C2O${\;}_{4}^{2-}$、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | D. | Na+、Ca2+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com