
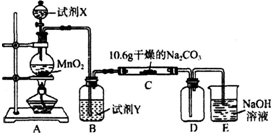
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取C中的少量固體樣品于試管中,滴加 足量蒸餾水至固體溶解,然后將所得溶液分別置于A、B試管中. | |
| 步驟2:向A試管中滴加BaCl2溶液 | ①若無明顯現象,證明固體中不含碳酸鈉; ②若溶液變渾濁,證明固體中含有碳酸鈉. |
| 步驟3:向B試管中滴加過量的稀硝酸,再滴加AgNO3溶液 | 若溶液變渾濁,結合步驟2中的①,則假設 一成立;結合步驟2中的②,則假設二成立. |
分析 (1)二氧化錳與濃鹽酸在加熱條件下生成氯氣、氯化錳和水;
(2)制備氯氣中含有氯化氫氣體,氯化氫易溶于水,氯氣在飽和食鹽水中溶解度不大,需要用飽和食鹽水除去氯化氫;
(3)在裝置C中通入一定量的氯氣后,測得D中只有一種常溫下為黃紅色的氣體(含氯氧化物).C中含氯元素的鹽只有一種,且含有NaHCO3.
假設存在兩種成分,為NaHCO3和NaCl;
假設存在三種成分,應還有未完全反應的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
步驟2中向A試管中滴加適量BaCl2溶液,是檢驗產物中是否有Na2CO3;
步驟3應是檢驗氯離子,應向B試管中滴加過量的稀硝酸,再滴加AgNO3溶液,若溶液變渾濁,證明固體中含有NaCl;
(4)依據氧化還原反應電子守恒計算判斷氯元素化合價寫出化合物化學式,依據反應物和生成物配平書寫化學方程式;
(5)依據碳酸鈉和碳酸氫鈉溶液中存在的質子守恒表達式計算解答;
鹽酸先和碳酸鈉反應,生成碳酸氫鈉方程式為:Na2CO3+HCl=NaHCO3+NaCl,碳酸氫鈉再和鹽酸反應,生成CO2
方程式為:NaHCO3+HCl=NaCl+CO2↑+H2O,完全反應后,CO2溶于水顯酸性,溶液呈中性,說明NaHCO3(堿性)應有剩余.
解答 解:(1)實驗室用二氧化錳和濃鹽酸制氯氣,離子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案為:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)制備氯氣中含有氯化氫氣體,需要用飽和食鹽水除去,故答案為:飽和食鹽水;
(3)①在裝置C中通入一定量的氯氣后,測得D中只有一種常溫下為黃紅色的氣體(含氯氧化物),C中含氯元素的鹽只有一種,且含有NaHCO3.
假設存在兩種成分,為NaHCO3和NaCl;
假設存在三種成分,應還有未完全反應的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
故答案為:NaCl;NaCl;Na2CO3;
②步驟2中向A試管中滴加適量BaCl2溶液,是檢驗產物中是否有Na2CO3;
步驟3應是檢驗氯離子,應向B試管中滴加過量的稀硝酸,再滴加AgNO3溶液,若溶液變渾濁,證明固體中含有NaCl;
故答案為:BaCl2溶液;過量的稀硝酸,再滴加AgNO3溶液;
(4)C中有0.1mol Cl2參加反應.裝置C中通入一定量的氯氣后,測得D中只有一種常溫下為黃紅色的氣體,若假設一成立,反應為Cl2+Na2CO3→NaHCO3+NaCl+X,依據氧化還原反應電子守恒計算判斷氯元素化合價為+1價:可推知C中反應生成的含氯氧化物為Cl2O;反應的化學方程式為:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
故答案為:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O;
(5)根據質子守恒,對于Na2CO3溶液中:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-),NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),兩者等濃度、等體積混合后,溶液中兩種溶質的物質的量相等,所以,將上述兩式疊加:[c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-)]+[c(OH-)+c(CO32-)=c(H+)+c(H2CO3)],移項,即得2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-),
c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-);
鹽酸先和碳酸鈉反應,生成碳酸氫鈉方程式為:Na2CO3+HCl=NaHCO3+NaCl,碳酸氫鈉再和鹽酸反應,生成CO2
方程式為:NaHCO3+HCl=NaCl+CO2↑+H2O,完全反應后,CO2溶于水顯酸性,溶液呈中性,說明NaHCO3(堿性)應有剩余,所以溶液中溶質的成分:NaCl、NaHCO3;
故答案為:$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-);NaCl、NaHCO3.
點評 本題為綜合題,考查了氯氣的實驗室制備、以及氯氣的化學性質、離子的檢驗知識,鹽類的水解平衡、電離平衡,題目難度中等,掌握物質性質和實驗設計方法是解題關鍵.


科目:高中化學 來源: 題型:選擇題

| A. | 圖中對應點的溫度關系為:a>b>c | |
| B. | 純水僅升高溫度,可從a點變到c點 | |
| C. | 水的電離常數KW數值大小關系為:b=d>c | |
| D. | 在b點對應溫度下,將pH=2的H2SO4與pH=10的NaOH溶液等體積混合后,溶液顯中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 16O2與18O2互為同分異構體 | |
| B. | 16O與18O核外電子排布方式相同 | |
| C. | 通過化學變化可以實現16O與18O間的相互轉化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA個氧原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硅及其化合物的開發由來已久,在現代生活中有廣泛應用.回答下列問題.
硅及其化合物的開發由來已久,在現代生活中有廣泛應用.回答下列問題.| 發生的主要反應 | |
| 電弧爐 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si+2CO↑ |
| 流化床反應器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 還原爐 |
| 物質 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸點/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
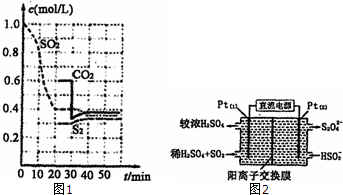 硫單質和化合物在工農業生產中有著重要的應用,而SO2直接排放會對環境造成危害.
硫單質和化合物在工農業生產中有著重要的應用,而SO2直接排放會對環境造成危害.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉塊在乙醇的液面上游動 | B. | 鈉塊并不熔化 | ||
| C. | 鈉塊沉在乙醇液面下面 | D. | 鈉塊表面有氣體放出 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com