
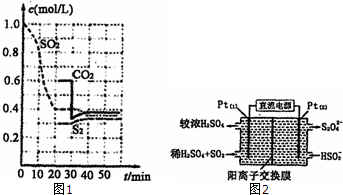
 硫單質和化合物在工農業生產中有著重要的應用,而SO2直接排放會對環境造成危害.
硫單質和化合物在工農業生產中有著重要的應用,而SO2直接排放會對環境造成危害.分析 I.已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根據蓋斯定律:③×2-①-②得:Ba(s)+S(s)+2O2(g)=BaSO4(s),反應熱也進行相應的計算;
Ⅱ.(1)①根據v=$\frac{△c}{△t}$計算v(SO2);
②30min時瞬間,二氧化碳濃度降低,S2的濃度不變,而后二氧化碳、S2的濃度均增大,應是減少CO2的濃度;
(2)①Na2SO3溶液與SO2反應生成亞硫酸氫鈉;
②a.根據電荷守恒判斷;
b.根據物料守恒判斷;
c.NaHSO3溶液中HSO3-的電離程度大于其水解程度;
d.水電離出氫離子濃度等于溶液中氫氧根離子濃度,由于NaHSO3溶液的pH未知,不能計算水電離出氫離子濃度;
(3)①由圖可知,Pt(1)電極上二氧化硫被氧化生成硫酸;
②左側電極反應式為:SO2-2e-+2H2O=SO42-+4 H+,根據電子轉移守恒計算生成硫酸根、氫離子的物質的量,為保持溶液電中性,多余的氫離子通過陽離子交換膜移至右側,左側溶液中增加離子為生成硫酸電離的離子總量.
解答 解:I.已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,
根據蓋斯定律:③×2-①-②得:Ba(s)+S(s)+2O2(g)=BaSO4(s),故△H=(-221 kJ?mol-1)×2-(+460 kJ?mol-1)-(+571.2 kJ?mol-1)=-1473.2KJ•mol-1,
故答案為:-1473.2KJ•mol-1;
Ⅱ.(1)①由圖可知,0-20min內二氧化硫濃度變化量為1mol/L-0.4mol/L=0.6mol/L,故v(SO2)=$\frac{0.6mol/L}{20min}$=0.03mol/(L•min),
故答案為:0.03mol/(L•min);
②30min時瞬間,二氧化碳濃度降低,S2的濃度不變,而后二氧化碳、S2的濃度均增大,應是減少CO2的濃度,故答案為:減少CO2的濃度;
(2)①Na2SO3溶液與SO2反應生成亞硫酸氫鈉,反應離子方程式為:SO32-+SO2+H2O=2HSO3-,故答案為:SO32-+SO2+H2O=2HSO3-;
②a.根據電荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正確;
b.溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素與硫元素物質的量之比為1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),故b正確;
c.NaHSO3溶液中HSO3-的電離程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故c正確;
d.水電離出氫離子濃度等于溶液中氫氧根離子濃度,由于NaHSO3溶液的pH未知,不能計算水電離出氫離子濃度,故d錯誤,
故答案為:abc;
(3)①由圖可知,Pt(1)電極上二氧化硫被氧化生成硫酸,電極反應式為:SO2-2e-+2H2O=SO42-+4 H+,
故答案為:SO2-2e-+2H2O=SO42-+4 H+;
②左側電極反應式為:SO2-2e-+2H2O=SO42-+4 H+,根據電子轉移守恒,生成硫酸根物質的量$\frac{0.02mol}{2}$=0.01mol,生成氫離子為0.04mol,為保持溶液電中性,0.01mol硫酸根需要0.02mol氫離子,多余的氫離子通過陽離子交換膜移至右側,即有0.02mol氫離子移至右側,故左側溶液中增加離子為0.01mol+0.02mol=0.03mol,
故答案為:0.03.
點評 本題屬于拼合型題目,涉及反應熱計算、反應速率計算、化學平衡影響因素、離子濃度比較、電極反應式書寫、電解池有關計算等,需要學生具備扎實的基礎,側重考查學生對知識的遷移應用,(3)中左側溶液中增加離子物質的量計算為易錯點,學生容易根據電極反應式計算,忽略部分氫離子移至右側.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
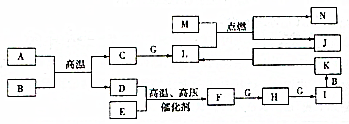 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中電子數相等,D、E、G、J、M為單質,M為金屬,J為黑色粉末,各物質轉化關系如圖所示,請回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中電子數相等,D、E、G、J、M為單質,M為金屬,J為黑色粉末,各物質轉化關系如圖所示,請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
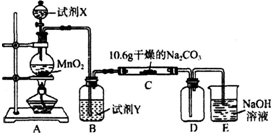
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取C中的少量固體樣品于試管中,滴加 足量蒸餾水至固體溶解,然后將所得溶液分別置于A、B試管中. | |
| 步驟2:向A試管中滴加BaCl2溶液 | ①若無明顯現象,證明固體中不含碳酸鈉; ②若溶液變渾濁,證明固體中含有碳酸鈉. |
| 步驟3:向B試管中滴加過量的稀硝酸,再滴加AgNO3溶液 | 若溶液變渾濁,結合步驟2中的①,則假設 一成立;結合步驟2中的②,則假設二成立. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 節能減排是當下環境保護的重點.
節能減排是當下環境保護的重點.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器編號 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比較 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
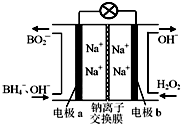 以硼氫化合物NaBH4(B元素的化合價為+3價)和H2O2作原料的燃料電池,負極材料采用Pt/C,正極材料采用MnO2,其工作原理如圖所示.下列說法正確的是( )
以硼氫化合物NaBH4(B元素的化合價為+3價)和H2O2作原料的燃料電池,負極材料采用Pt/C,正極材料采用MnO2,其工作原理如圖所示.下列說法正確的是( )| A. | 電池放電時Na+從b極區移向a極區 | |
| B. | 該電池的負極反應為:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 電極a采用MnO2,MnO2既作電極材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,轉移的電子為3 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 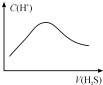 隨著 H2S氣體的通入,溶液中由水電離出的c(H+)有如圖變化關系 | |
| B. | 當$\frac{V}{22.4}$=a b時,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 當$\frac{V}{11.2}$=a b時,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 當$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$時,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu(IO3)2作氧化劑,Cu(IO3)2中的銅和碘元素被還原 | |
| B. | CuI既是氧化產物又是還原產物 | |
| C. | 每生成1 mol CuI,有12 mol KI發生氧化反應 | |
| D. | 每轉移1.1 mol電子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 12克金剛石中含有的C-C鍵數目為為4NA | |
| B. | 1 L 0.1 mol•L-1 NH4Cl溶液中含有0.1NA個NH4+ | |
| C. | 常溫常壓下,22.4L乙烯與丙烯的混合物中含有的分子數目為NA | |
| D. | 常溫常壓下,Na2O2與足量H2O反應生成0.2molO2,轉移電子的數目為0.4NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com