
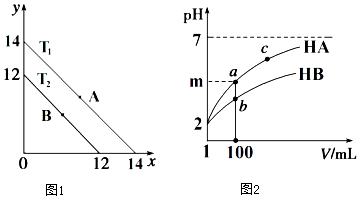
 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x與y的關系如圖1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x與y的關系如圖1所示.分析 (1)①A點時Kw=10-14,B點時Kw=10-12,從A點到B點Kw增大;
②將pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,溶液中氫離子濃度增大,根據Kw=c(H+)×c(OH-)判斷;
③已知:T1℃時,醋酸的電離常數為 1.8×10-5,根據Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$計算c(H+),再根據Kw=c(H+)×c(OH-)計算;
④T2℃時,Kw=10-12,將某溶液(此溶液滿足 lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=10),則c(H+)=10-11mol/L,溶液顯堿性;
(2)①體積均為1mL pH=2的一元酸HA和HB,加水稀釋100倍,pH變化為2或小于2;
②稀釋相同的倍數HB的pH變化小,則HB的酸性弱;
③若 m<4,則HA為弱酸,加水稀釋促進電離,n(A-)增大,但是c(A-)減小,據此分析;
(3)弱酸的電離平衡常數越大,其酸性越強,酸性強弱順序是H2CO3>HCN>HCO3-,結合強酸能和弱酸鹽反應制取弱酸分析解答.
解答 解:(1)①A點時Kw=10-14,B點時Kw=10-12,從A點到B點Kw增大,所以可采取的措施為升高溫度;
故答案為:升高溫度;
②將pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,溶液中氫離子濃度增大,由Kw=c(H+)×c(OH-)可知,c(OH-)減小,溶液中氫氧根離子由水電離,所以水電離出的c(OH-)將減小;
故答案為:減小;
③已知:T1℃時,醋酸的電離常數為 1.8×10-5,由Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$可知,c(H+)=$\sqrt{0.5×1.8×1{0}^{-5}}$=3×10-3mol/L,由Kw=c(H+)×c(OH-)=10-14可知,水電離出的 c(H+)=$\frac{1}{3}$×10-11mol/L,則由醋酸電離出的 c(H+)約是水電離出的 c(H+)的倍9×108;
故答案為:9×108;
④T2℃時,Kw=10-12,將某溶液(此溶液滿足 lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=10),則c(H+)=10-11mol/L,溶液顯堿性,所以溶液中HS-不能大量共存,發生的離子方程式為:HS-+OH-=S2-+H2O;
故答案為:HS-+OH-=S2-+H2O;
(2)①體積均為1mL pH=2的一元酸HA和HB,加水稀釋100倍,若HA為強酸,則pH變化為2,若HA為弱酸,則pH變化小于2,所以m的取值范圍為:2<m≤4;
故答案為:2<m≤4;
②稀釋相同的倍數HB的pH變化小,則HB的酸性弱,所以a點酸的濃度<b點酸的濃度;
故答案為:<;
③若 m<4,則HA為弱酸,加水稀釋促進電離,
A.加水稀釋促進電離,n(A-)增大,但是c(A-)減小,故A錯誤;
B.c(H+)×c(OH-)不變,由于體積增大,所以n(H+)•n(OH-)增大,故B正確;
C.加水稀釋促進電離,n(A-)增大,n(H+)增大,由于c(H+)減小,所以水電離的n(H+)也增大,所以$\frac{c({H}^{+})}{c({A}^{-})}$ 增大,故C正確;
D.$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$=$\frac{1}{{K}_{h}}$,由于水解常數Kh不變,所以$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$不變,故D錯誤.
故答案為:BC;
(3)依據強酸制取弱酸的原理,NaCN溶液中通入少量的CO2離子方程式為:CN-+H2O+CO2=HCN+HCO3-,
故答案為:CN-+H2O+CO2=HCN+HCO3-.
點評 本題考查了酸堿混合時的定性判斷和pH的有關計算、弱電解質的電離,明確Ka與酸性的關系、弱酸的電離度與濃度的關系及圖象分析為解答的關鍵,側重分析與應用能力的考查,題目難度中等.


 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑤ | B. | ③④ | C. | ② | D. | 全都不行 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開發廢舊電池綜合利用技術,防止重金屬鹽對土壤水資源造成污染 | |
| B. | 綠色化學的核心是應用化學原理對環境污染進行治理 | |
| C. | 倡導低碳生活,使用太陽能、風能等代替化石燃料,可減少溫室氣體的排放 | |
| D. | 垃圾是放錯地方的資源,應分類回收利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將20gNaOH溶解在500mL水中 | |
| B. | 將22.4L HCl氣體溶于水配成1 L溶液 | |
| C. | 將1 L 10 mol•L-1濃鹽酸加入9L水中 | |
| D. | 將10gNaOH溶解在少量水中,恢復至室溫,再加蒸餾水直到溶液體積為250mL |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
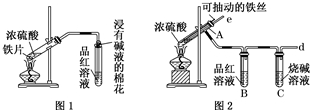 某校化學興趣小組為探究鐵與濃硫酸反應,設計了圖1、圖2所示裝置進行實驗.
某校化學興趣小組為探究鐵與濃硫酸反應,設計了圖1、圖2所示裝置進行實驗.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com